Природа старения – одна из загадок биологии, хотя проявления этого процесса знакомы всем. За последние пару сотен лет средняя продолжительность жизни людей существенно выросла: человечество усвоило главные правила гигиены и санитарии, детская смертность снизилась благодаря вакцинации, а изобретение антибиотиков позволило бороться с инфекциями. Но выросла именно средняя продолжительность жизни – максимальная практически не изменилась! И только достижения биологической науки последних лет дали надежду на появление технологий, которые замедлят процессы старения у человека

Академик РАН
научный руководитель
Институт химической биологии е фундаментальной медицины СО РАН

член-корреспондент РАН
зав. лабораторией
Как мы знаем, после достижения определенного возраста люди слабеют, становятся более медлительными, менее выносливыми и сообразительными. Они чаще болеют инфекционными, аутоиммунными и опухолевыми заболеваниями из-за нарушений функции иммунной системы. У них начинаются проблемы с сердечно-сосудистой системой, атрофируются клетки нервных волокон. Короче говоря, ухудшаются функции всех органов и систем, что в конце концов приводит к смерти, но не «от старости вообще», а от какой-нибудь конкретной болезни, с которой ослабленный организм не может справиться.

Turritopsis rubra – ближайшая родственница крошечной «бессмертной медузы» T. dohrnii, которая способна жить практически вечно, периодически возвращаясь на более молодую стадию полипа. Умеет ли и эта медуза вытворять такие фокусы, пока неизвестно. © CC BY-SA 4.0/ Tony Wills
Видимым образом старение человека начинает проявляться в возрасте примерно 40 лет, хотя уже в 20 лет может меняться мозговая активность, а спустя еще десяток лет – и мышечная. На молекулярном и клеточном уровне у пожилых людей наблюдаются нарушения работы митохондрий («клеточных электростанций»), укорачиваются хромосомные колпачки-теломеры, изменяется распределение эпигенетических (не меняющих саму структуру нуклеиновой кислоты) меток в ДНК. Все это приводит к каскаду метаболических нарушений и старению клеток, развитию воспаления и несостоятельности органов, что провоцирует рак, сахарный диабет и деменцию.
Но все же почему люди стареют, почему не живут полноценной жизнью лет по триста? И можно ли каким-то образом повлиять на процессы старения? К сожалению, исчерпывающих ответов на все эти вопросы пока нет.
Старение: известное, неясное и непонятное
Длительность жизни различных организмов сильно варьирует. Как известно, некоторые деревья живут тысячи лет, а некоторые насекомые – считанные часы. И здесь появляется вопрос: можно ли считать жизнь человека долгой?
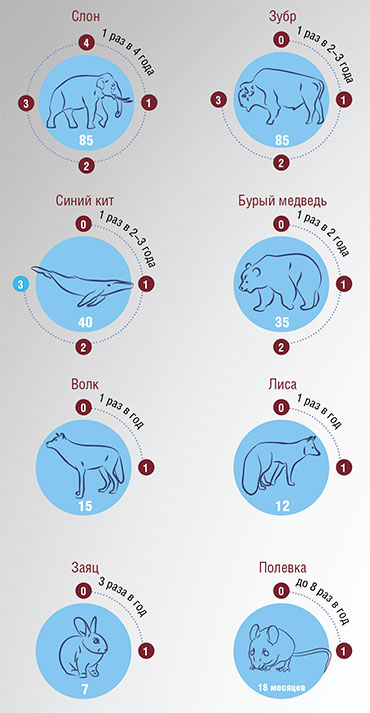
В литературе любят приводить цифры относительно максимальной продолжительности жизни животных. Вот некоторые примеры достоверных данных: домовая мышь – 4 года, собака – от 29 до 34 лет, слон – 69–86 лет, осетр – 152 года. Среди позвоночных в лидерах галапагосская черепаха – 177 лет, гренландская полярная акула – 270–510 лет, гренландский кит – 210 лет.
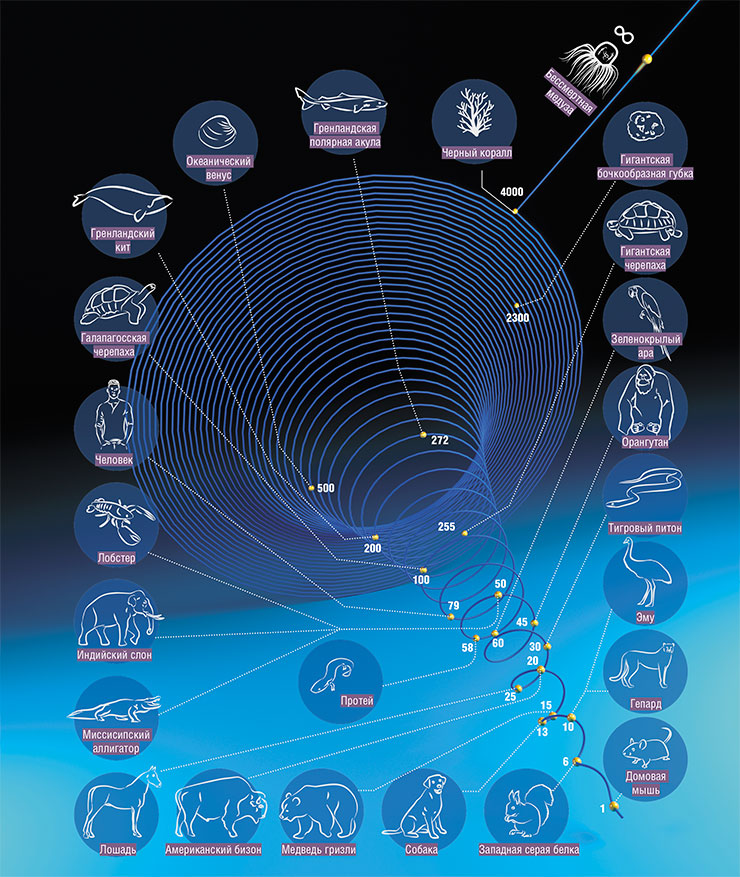
Ожидаемая продолжительность жизни разных животных: от беспозвоночных и рыб до пресмыкающихся, птиц и млекопитающих. Среди супердолгожителей – медуза, бесконечно прокручивающая свой жизненный цикл, и губка, у которой нет тканей, а все клетки тела равноправны. Антирекорд среди млекопитающих – у мелких грызунов, жизнь которых укладывается в один год. По: (Aran, 2022)
Заметим, что в наличии долгожителей среди домашних собак и кошек, так же как и среди черепах и слонов в зоопарках, сомневаться не приходится: даты их рождения и смерти задокументированы. А вот по поводу акул и прочих рекордсменов в дикой природе, которые живут без присмотра и паспорта, следует проявлять осторожность. В природных условиях животные погибают от болезней, хищников, нехватки еды – до биологической старости они могут дожить лишь в искусственных условиях. Поэтому приведенные выше цифры – лишь оценки, полученные с помощью разных методов (например, возраст китов датировали по найденным в их телах гарпунам, а акул – по радиоуглеродному анализу белков хрусталика глаза).
Еще любят писать об африканских грызунах голых землекопах, которые живут десятилетиями и якобы даже не болеют. Явление супердолгожительства таких животных называют пренебрежимым старением.
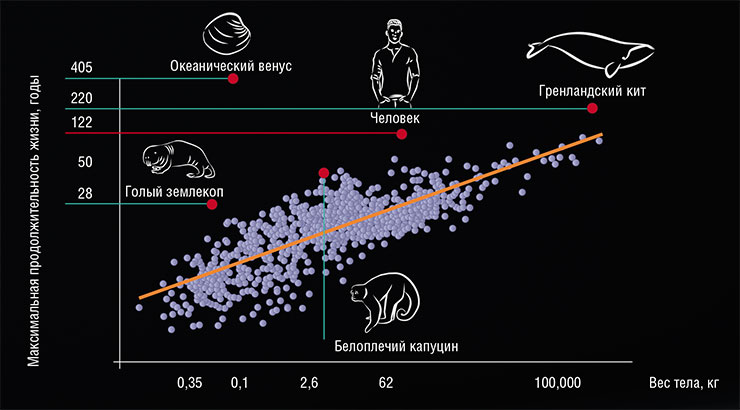
Продолжительность жизни животного зависит от веса его тела: крупные особи живут дольше. Но и здесь есть исключения, в том числе среди позвоночных: некоторые виды живут дольше, чем ожидалось, включая человека. По: (AnAge Database; de Magalhaes et al.)
Здесь стоит пояснить, что представляет собой старение с точки зрения статистики. Если взять много любых объектов, в принципе имеющих конечный срок существования (людей, радиоактивных атомов, лампочек накаливания), и наблюдать за ними долгое время, то можно определить то, что называют «интенсивностью отказов».
И здесь важный нюанс. Атомы и лампочки не стареют. Для любого радиоактивного атома вероятность распасться в любое время одна и та же, и включенная лампочка может перегореть с одинаковой вероятностью в любое время. Если взять очень много атомов или лампочек, то их число будет убывать по очень простому экспоненциальному закону: через какое-то время, называемое периодом полураспада (или временем полужизни, если речь идет не об атомах), их останется половина, через два периода полураспада – четверть, через три – одна восьмая…

Старейшая на планете касатка, родившаяся приблизительно в 1911 г., прозванная Бабулей (Granny), прожила больше ста лет. 2014 г. Государственный парк Лайм Килн Пойнт (США). © CC BY-NC-ND 2.0/Andrew Reding
Не то что с живыми существами. Еще в XIX в. статистики Б. Гомпертц и У. Мейкхам, работавшие на британские страховые компании, на основе большого демографического материала показали, что вероятность смерти человека с возрастом также увеличивается экспоненциально.
Так что, если мы возьмем много одновременно родившихся людей, их число будет убывать со временем по «экспоненте в степени экспоненты»: медленно в начале и очень быстро в конце. Закон Гомпертца – Мейкхама очень хорошо работает в возрастном интервале 30–80 лет, и на него до сих пор опираются страховые компании при расчетах взносов и выплат. А пренебрежимое старение – это именно тот случай, когда живые существа ведут себя как лампочки.
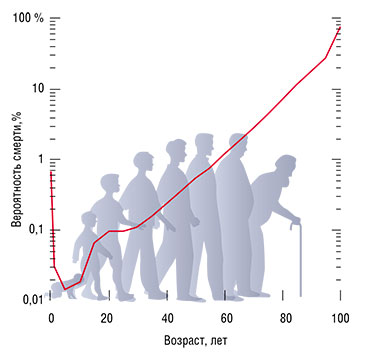
Если разбираться подробнее, то в формуле Гомпертца – Мейкхама есть два члена: «независимый от возраста» и «зависимый». С тех пор, как человечество начало вести более-менее надежную демографическую статистику, практически все увеличение продолжительности жизни шло за счет независимого от возраста компонента смертности – основной вклад внесли улучшение санитарно-гигиенической ситуации и лучшая обеспеченность продуктами питания. А вот зависимый от возраста компонент никак не поменялся, с самим старением пока ничего сделать не удалось.
Почему закон Гомпертца – Мейкхама не работает после 80 лет? Кстати сказать, на самом деле никто точно не знает, отказывает он или нет. Проблема в том, что даже для человека – вида, для которого имеется огромный объем демографических данных, – до самого последнего времени известных долгожителей было слишком мало, чтобы надежно экстраполировать число доживших какой-то математической функцией. Есть подозрения, что начиная с 1950‑х гг. вероятность смерти для очень старых людей стала уменьшаться, но статистики до сих пор спорят, действительно ли это так. В любом случае очевидно, что для надежного анализа кривых выживания нужно иметь очень много данных.
Но если таких данных не всегда достаточно даже для человека, то что говорить о том же голом землекопе? Эти грызуны действительно живут долго, и зоологи, занимающиеся ими профессионально, легко отличат пожилую особь от молодой: «старики» менее активны, их кожа гораздо светлее, тоньше и менее эластична; у них наблюдаются типичные для млекопитающих возрастные изменения, такие как атрофия мышц, остеоартрит, катаракта, фиброз почек… Иными словами, старение-то однозначно есть, вопрос лишь в том, зависит ли его скорость от возраста животного. И вот тут имеющихся данных не хватает для уверенного ответа – разные ученые делают различные выводы. И такой неопределенностью грешат почти все существа, которым приписывают пренебрежимое старение.

Голые землекопы (Heterocephalus glaber) – небольшие роющие грызуны сухих равнин Восточной Африки. Обитают в экстремальных условиях, включая высокую концентрацию углекислого газа в подземных норах, а социальное устройство их колоний напоминает общественных насекомых. Эти долгожители не чувствуют боли при действии высокой температуры и не болеют раком. © CC BY-NC-ND 2.0/ Josh More
Однако в природе есть и практически бессмертные создания, у которых во взрослом состоянии все ткани тела постоянно обновляются за счет большого количества стволовых клеток. Это низшие беспозвоночные животные – морские актинии, пресноводные гидры. Потенциально бессмертной считается медуза Turritopsis dohrnii, которая может в любой момент своей жизни под действием самых разных факторов «омолодиться», превратившись из свободноплавающей половозрелой особи в прикрепленного ко дну гидроидного полипа – более раннюю стадию своего жизненного цикла.
Как стареют люди?
Продолжительность жизни людей – вопрос особый. Люди умеют защищаться, у них есть медицина, потому они и живут долго по сравнению с животными сходных размеров. Но у них много старческих болезней – люди просто до них доживают. Ведь вряд ли неандертальцы, жившие в среднем не более 30 лет, страдали от болезни Альцгеймера.
Оценки, основанные на разных моделях старения, дают сходную цифру: средняя продолжительность жизни человека – примерно 85 лет. И в развитых странах мира она приближается к этой цифре. В этом случае 40 % людей должны дожить до 90 лет, около 5 % – до 100 лет, а единицы – еще дольше.
Существует много легенд о людях, которые якобы жили сотни лет. Однако информация о проживших более 120 лет не подтверждена надежными документами. Титул старейшего человека за всю историю до сих пор принадлежал француженке Жанне Кальман, которой на момент смерти в 1997 г. якобы исполнилось 122 года и 164 дня, но эти данные теперь подвергают сомнению.
Один из очевидных факторов, определяющих долгожительство, – наследственность. Исследования показали, что шансы ребенка стать долгожителем тем выше, чем больше у него родственников-долгожителей (родителей, братьев, сестер). Если родители человека прожили больше 80 лет, то для него вероятность попасть в категорию долгожителей будет в 1,7–1,8 раз выше, чем для потомка недолгоживущих. Но вклад генетики в долгожительство не так уж и велик – около 7 %, остальное определяют другие факторы. Специального гена, ответственного за долгожительство, не обнаружено. Очевидно, оно определяется большим набором генов, способствующих борьбе с болезнями и обеспечивающих хорошее состояние тканей и органов индивидуума.Среди ученых нет единства относительно максимальной продолжительности жизни человека. В 2000 г. два ведущих американских специалиста в области старения, придерживающиеся противоположных точек зрения, – оптимист С. Остад из Университета Алабамы в Бирмингеме и пессимист С. Д. Ольшанский из Иллинойского университета в Чикаго – даже заключили пари, может ли человек прожить 150 лет. Каждый из них поместил в инвестиционный фонд по 150 долларов. В 2150 г. деньги с процентами должен получить тот из них (или из их потомков), кто окажется прав относительно предсказания о наличии в мире на тот момент хотя бы одного 150‑летнего долгожителя. Ожидается, что к тому времени выигрыш составит солидную сумму. Пожелаем фонду не лопнуть, а самим ученым дожить до этого дня
Наблюдаемое сейчас замедление роста продолжительности жизни напоминает ситуацию в современном спорте. Ведь последние полвека в легкой атлетике рекорды почти не растут, что неудивительно: человек просто не может бежать со скоростью 100 км/час или прыгнуть на 10 м в высоту. То же самое и с продолжительностью жизни.

И никаких больных суставов! Ежедневная зарядка посреди туристической тропы вдоль пляжа Циндао (Китай). © CC BY 2.0 / Gauthier DELECROIX
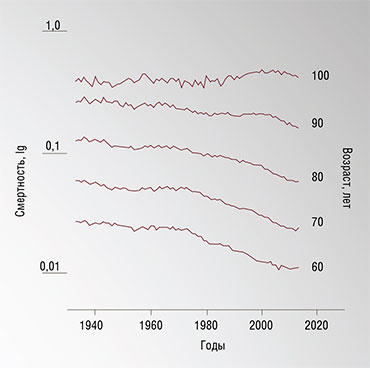
Растущие возможности медицины и улучшение условий жизни привели к тому, что в последние годы выросло число людей, достигающих возраста 90 и 100 лет. Однако преодолевших рубеж 120 лет нет вообще. И это при том, что в разных странах условия жизни людей очень различаются, как и смертность в соответствующих возрастных группах: к примеру, в Индии она намного выше, чем в Швеции. Ведь, казалось бы, чем благополучнее страна, тем выше должна быть и максимальная продолжительность жизни. Но нет: в разных странах она практически одинакова. Выглядит это так, как будто у продолжительности жизни есть некий предел. Все доступные простые способы продления жизни человек уже использовал, и положение не изменится, если только не будет изобретено что-то принципиально новое.
Зачем стареть и зачем жить долго?
Принципиальный вопрос: в чем биологический смысл смерти?
Биологи утверждают, что с точки зрения эволюции бессмертие вредно. Произведя потомство, родители становятся помехой, конкурируя с детьми за природные ресурсы. Да и эволюция зайдет в тупик, если все будут жить вечно. Однако вряд ли процессы старения организма являются эволюционно приобретенными адаптивными приспособлениями. Естественный отбор работает на генах, которые нужны молодым, когда они взрослеют и размножаются. Тех, кто прожил дольше и уже не передают свои гены потомству, эволюция игнорирует.
Обычно продолжительность жизни вида связана с его плодовитостью: чем интенсивнее животные размножаются, тем меньше живут. Это можно объяснить: маленькие беззащитные мыши в присутствии хищников и других угроз в любом случае долго не протянут, и чтобы выживать, им необходимо успеть произвести как можно больше потомков за минимальное время. Их гены должны обеспечить интенсивную короткую жизнь, эволюция работает именно над этим. Вредные мутации, которые оказывают негативное воздействие после окончания репродуктивного периода, могут накапливаться в их геноме, потому что они ускользают от действия отбора.
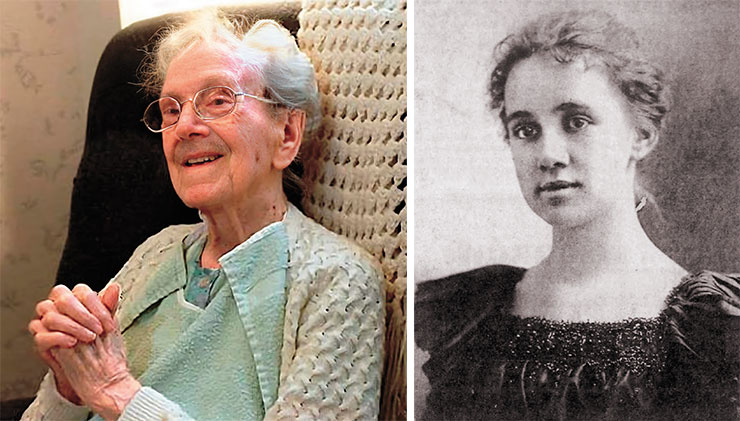
Американская домохозяйка Сара Де-Ремер Кнаусс входит в тройку самых долгоживущих людей мира, чей возраст был официально зарегистрирован. Она прожила 119 лет 97 дней и умерла в 1999 г. Долголетие Сары можно считать наследственным: ее бабушка по отцовской линии дожила до 98 лет, а единственная дочь умерла в возрасте 101 года, пережив мать на шесть лет. Слева – Сара Кнаусс в возрасте 115 лет. Справа – долгожительница в возрасте 17 лет. 1897 г. Public Domain
Таким образом, повышение смертности от внешних условий приводит к эволюционному сокращению продолжительности жизни. И наоборот: те виды, которые не испытывают сильного давления среды (большого размера или живущие в защищенной среде), живут дольше. У них закрепляются мутации, способствующие долгожительству. Китам, слонам и голым землекопам требуются, к примеру, эффективные системы репарации (ремонта) ДНК, защищающие генетические программы от повреждений внешними факторами, и у них они сформировались. Короткоживущим мышам можно обойтись и менее эффективной репарацией, ведь за короткую жизнь гены серьезно пострадать не успеют.
Но есть, однако, способ доказать эволюции свою необходимость даже после завершения репродуктивного возраста – если вы принадлежите к социальному виду. Необычно долгую жизнь людей по сравнению с другими приматами объясняет гипотеза о «полезных бабушках». В отличие от других животных, детеныши людей долгое время совершенно беспомощны, им необходимы защита и уход. Для их успешного выживания нужны долгоживущие родители и прародители, поэтому семейные гены, позволяющие взрослым жить дольше, закрепятся и у их детей. Так что именно зависимость от родителей и дедушек с бабушками, похоже, способствовала закреплению мутаций, обеспечивающих человеку относительно долгую жизнь. Если бы не бабушки, мы жили бы в среднем 35–40 лет, как наши обезьяньи «родственники».
Молекулы старения
Относительно самой природы процесса старения у ученых нет единого мнения. Изучая процессы, которые происходят на уровне клеток и органов, ученые предложили несколько сотен теорий, объясняющих старение. Это свидетельствует прежде всего о многофакторности процесса и о том, что настоящего понимания его природы на сегодня нет.
Некоторые верят, что старение – не случайный, а запрограммированный процесс. Исходя из этого, они считают, что программу старения можно «взломать», как и любую другую, и таким образом старение «вылечить». Эту теорию очень любят биохакеры и продавцы «волшебных» препаратов, обещающие бессмертие уже сегодня, но не ученые. Самый простой и весомый аргумент против нее – тот факт, что примеры отказов такой программы неизвестны. Ведь рано или поздно она должна была бы, в результате мутаций, отказать у кого-то из людей, но появления бессмертных мы не наблюдаем.
Вторая теория, более правдоподобная, предполагает, что старение вызывается накоплением повреждений биомолекул и клеточных структур в результате воздействия множества повреждающих факторов. Так, в 1956 г. американский биохимик Д. Харман предложил теорию старения, согласно которой все эти беды происходят из-за свободных радикалов – реакционноспособных молекул, образующихся в организме под влиянием действия кислорода, радиоактивного излучения и как продукты естественного метаболизма.
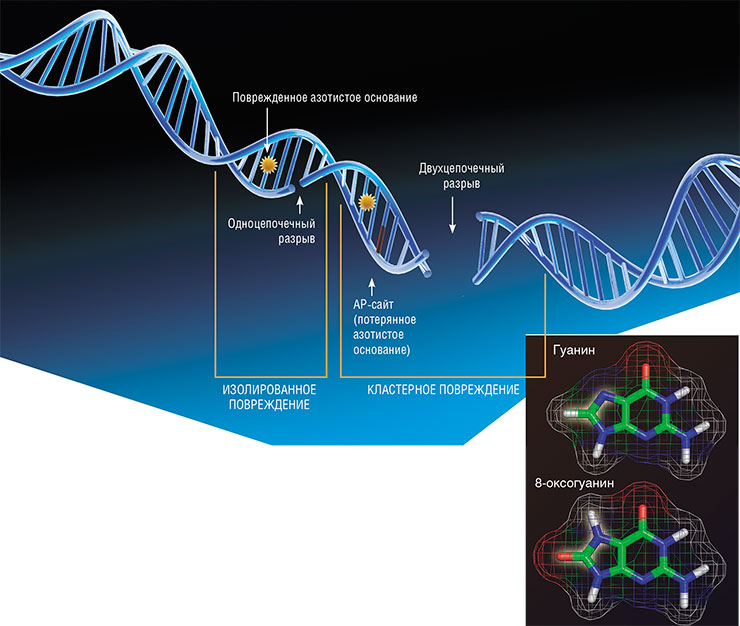
Под действием ряда внешних и внутренних факторов, таких как УФ-излучение и свободные радикалы, молекулы ДНК повреждаются. Наиболее опасны для клеток двухцепочечные разрывы, а также кластерные повреждения из комбинации AP-сайтов, окисленных оснований и разрывов в пределах 1–2 витков спирали ДНК. По: (Косова, Лаврик, Ходырева, 2014). Справа – окисленное азотистое основание 8-оксогуанин. Окисленный гуанин способен образовывать как обычную связь с цитозином, так и «нестандартную» связь с аденином, что может приводить к ошибкам при сборе комплементарной цепи ДНК. По: (Жарков, 2006)
Свободные радикалы, а также различные химические вещества, попадающие в наш организм с продуктами питания или как загрязнители, могут вызывать повреждения ДНК и белков, изменять функционирование ферментных систем и свойства клеточных мембран, приводить к различным сбоям биохимических процессов. В результате выводятся из строя генетические программы, нарушаются энергетические процессы, функционирование иммунной и других жизненно важных систем организма. Все это способствует развитию патологических процессов, которые ускоряют приближение смерти.
Для самой важной молекулы в клетке – ДНК – имеются уже упомянутые системы репарации, от надежности и точности которых зависит способность организма противостоять постоянно возникающим повреждениям генома. Ослабление этих систем ведет к развитию онкологических заболеваний, а в некоторых случаях и к прогерии – ускоренному старению всего организма. Например, люди, страдающие синдромом Вернера (наследственным отсутствием одного из ферментов репарации), начинают стареть с 15–20 лет, а в возрасте 40 лет выглядят как восьмидесятилетние старики.
Так что старение, похоже, действительно связано с накоплением повреждений в организме. Но все ли они одинаково вредны?
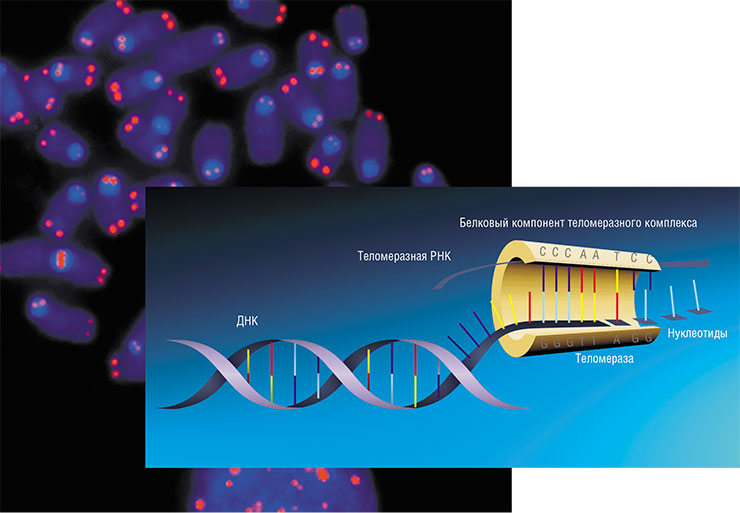
Фермент теломераза «пришивает» новые нуклеотиды к теломерным участкам ДНК, укорачивающимся при делении клетки. Теломераза содержит короткую молекулу РНК, последовательность которой комплементарна теломерному повтору, – она используется как матрица для синтеза 3’-конца теломерной ДНК. Достроив один участок, теломераза сдвигается, чтобы повторить цикл. Вторая цепь ДНК достраивается уже другим ферментом в ходе следующего деления клетки. По: (Королева, 2016). Вверху слева – препарат хромосом, на котором теломеры окрашены красным цветом. Некоторые хромосомы лишены теломер, что может привести к аномальному делению клеток и раку. © CC BY-NC 2.0 / Thomas Ried, NCI Center for Cancer Research, NIH
Одно время популярной стала теория «катастрофы ошибок», согласно которой накопление повреждений может привести к отказу любой из систем организма. В самом деле, в почтенном возрасте одни люди умирают от проблем с сердечно-сосудистой системой, другие становятся жертвой рака, кто-то поддается нейродегенеративным заболеваниям. Но есть ли на молекулярном или клеточном уровне мишени, особенно чувствительные к старению?
В конце прошлого века многим казалось, что на эту роль подходят теломеры, особые участки на конце хромосом, которые утрачиваются после определенного числа клеточных делений. Этот лимит, названный пределом Хейфлика в честь его первооткрывателя, составляет 40–60 делений для большинства человеческих клеток. С каждым клеточным делением теломеры укорачиваются, и только в половых, зародышевых и стволовых (недифференцированных) клетках они достраиваются специальным ферментом теломеразой, что позволяет этим клеткам непрерывно делиться, формируя ткани и органы. Окончательно дифференцированные клетки, такие как нейроны, могут жить десятки лет, но они не делятся и не производят теломеразу.
С возрастом из-за накапливающихся повреждений теломеры становятся короче даже в «неспециализированных» стволовых клетках, из-за чего обновление клеток в разных органах постепенно прекращается, что особенно критично для иммунной системы. У пожилых людей наблюдается обратная связь между длиной теломер и риском смерти от разных заболеваний.
Не так давно ученые обратили внимание на другую группу потенциальных виновников старения на клеточном уровне – ретротранспозоны. Эти мобильные генетические элементы, составляющие более трети человеческого генома, считаются «генетическими паразитами». Они не играют никакой известной роли, однако могут служить матрицей для синтеза РНК, с которой затем считывается фермент, синтезирующий новую ДНК-копию ретротранспозона и встраивающий ее в произвольное место в клеточной ДНК.
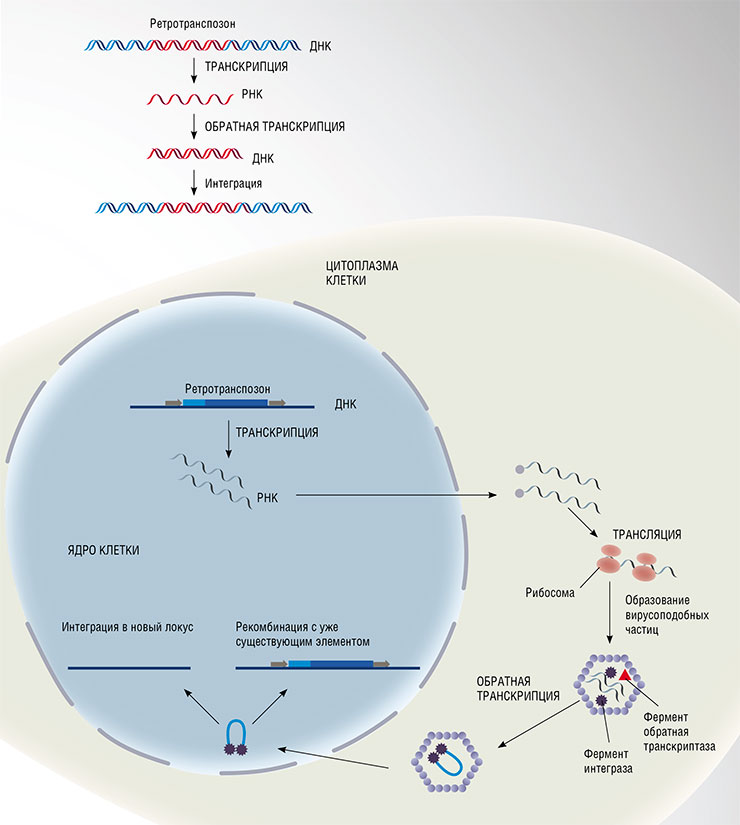
Способность ретротранспозонов «прыгать» по геному клетки основана на явлении «обратной транскрипции». Согласно центральной догме молекулярной биологии, поток информации в клетке идет в направлении от ДНК к РНК (транскрипция) и далее к белку (трансляция). Однако существует и обратный путь: синтез ДНК по матрице РНК. Его используют РНК-содержащие вирусы, чтобы встроить свой наследственный материал в геном хозяйской клетки, и собственные мобильные элементы клетки, ретротранспозоны. Слева – пример цикла репликации ретротранспозона. По: (Servant, Deininger, 2016)Ретротранспозоны – это мобильные генетические элементы, родственные ретровирусам, ДНК которых встраивается в геном хозяина. В отличие от ретровирусов, они могут перемещаться и размножаться только внутри одной клетки, поэтому способны передаваться лишь в череде поколений.
По мнению специалистов, ретровирусы появились в результате определенной «эволюции» ретротранспозонов. В дальнейшем могли происходить и обратные процессы, когда ретровирус терял свою инфекционность в результате мутации
Неудивительно, что при нерегулируемой активности ретротранспозонов клетка быстро «идет вразнос», поэтому в молодых клетках за ними установлен строгий контроль: эти участки генома подвергаются метилированию и конденсации в плотные ДНК-белковые агрегаты (гетерохроматин), в которых синтез РНК невозможен.

Со временем из-за повреждений ДНК этот контроль ослабевает, уровень метилирования и конденсации снижается, и транспозоны начинают «прыгать» по всему геному, мешая его нормальной работе. Результат тот же, что и с теломерами: старение стволовых клеток и прекращение обновления критически важных тканей и органов. Интересно, что у человека и голого землекопа, по сравнению с мышами и многими короткоживущими млекопитающими, активных транспозонов очень мало.
Возможно, однако, что человек стареет вовсе не из-за повреждений ДНК. Еще один фактор, который может играть в этом большую роль, – это накопление повреждений межклеточного матрикса, среды, в которой находятся клетки. Матрикс состоит из биополимеров разной природы (белков, гиалуроновой кислоты и т. п.) и не только выполняет структурные функции, но и влияет на дифференцировку клеток.
Время жизни белков (эластина, коллагена) в составе матрикса измеряется годами и даже десятилетиями, так что со временем в них накапливаются повреждения, в частности сшивки между белковыми цепями. Это приводит к увеличению жесткости матрикса, что вызывает проблемы с сосудами и сердцем, способствует росту опухолей. Старение матрикса сказывается и на находящихся в нем клетках: если поместить молодые клетки в старый внеклеточный матрикс, они приобретут характеристики стареющих.
Кстати, у голых землекопов матрикс менее жесткий за счет повышенного содержания в нем высокомолекулярной гиалуроновой кислоты. Возможно, именно в этом один из секретов их долголетия?
«Молодая» кровь
До начала XXI в. какого-либо значимого прогресса в изучении практического долголетия не происходило. Биологи публиковали статьи о занятных фактах долгожительства моллюсков, деревьев и китов. Медики изучали старческие болезни, вырабатывали рекомендации для ухода за стариками в хосписах и писали обоснования для увеличения пенсионного возраста. А жулики потихоньку торговали средствами для укрепления сил организма, приворотными зельями и продлевающими жизнь эликсирами на основе разных кореньев, для крепости добавляя в них виагру и гормональные препараты.
Тихая жизнь исследователей долголетия была нарушена в 2005 г. публикацией сотрудников американского Стэнфордского университета Ирины и Майкла Конбой, которая пробуждает в памяти истории о вампирах и средневековых аристократках, принимающих ванны из крови молоденьких девушек.
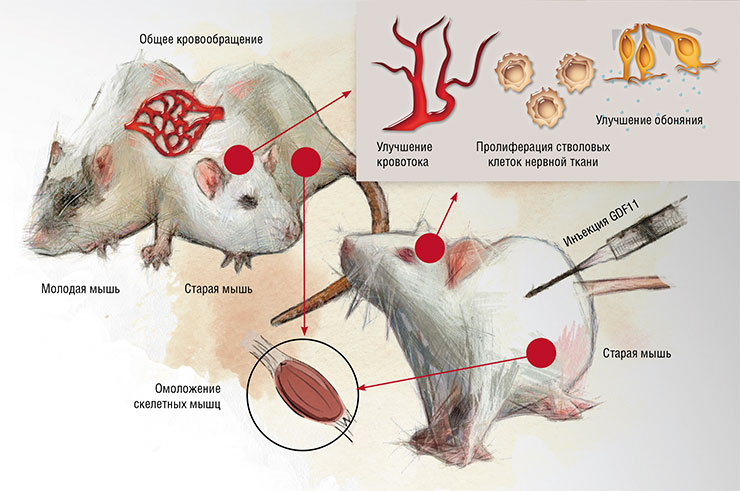
Создание хирургическим путем общего кровообращения между лабораторными мышами разного возраста, а также инъекции пожилым особям белка GDF11, полученного из крови молодых, приводили к одному результату: у «пожилых» мышей уменьшались признаки старения мышечной, нервной и кровеносной систем. По: (Kaiser, 2014)
Ученые решили проверить, действительно ли «молодая» кровь обладает особыми свойствами. В эксперименте они применили известный среди физиологов метод парабиоза – искусственного соединения животных через кровеносную систему, для чего «сшили» между собой кровеносные системы лабораторных мышей, старых и молодых. По сообщениям авторов, у старых животных, соединенных с молодыми, улучшилось размножение сателлитных клеток мышц (аналогов стволовых клеток) и клеток печени – эти органы как бы омолаживались.ОТ МОЛОДИЛЬНЫХ ЯБЛОК – К КЕФИРУМечты человека о вечной молодости отражаются в легендах о бессмертных богах, в былинах и сказках, где фигурируют «молодильные яблоки» и «эликсиры вечной юности». Известны и практические действия, направленные на продление жизни на основе советов колдунов и мудрецов. Так, китайские императоры и римские патриции уповали на физиотерапию и сон в компании с юными девушками, а средневековые безумные властители искали бессмертия с помощью снадобий из человеческой крови.
С развитием науки появились новые идеи относительно способов замедлить процесс старения. Известный русский ученый И. И. Мечников считал, что одна из причин старения организма человека – гнилостные процессы в кишечнике, вызываемые болезнетворными бактериями, и справиться с ними можно, употребляя кисломолочные продукты.
Еще одна новаторская идея – пересадка людям семенников и других гормональных желез от животных, блестяще изложенная в «Собачьем сердце» М. Булгакова.
В свое время о том, как прожить подольше, задумывались и руководители СССР. Так, И. В. Сталин внимательно следил за работами основоположника советской школы патофизиологии, эндокринологии и геронтологии, академика А. А. Богомольца.
По инициативе ученого в 1941 г. в Киеве был открыт диспансер для борьбы с преждевременной старостью, на базе которого впоследствии был создан Институт геронтологии. За два года до этого в своем труде «Продление жизни» (1939) Богомолец научно обосновал возможность создания методов продления жизни человека до 100 лет и более. Ученому не отказывали в средствах, его отмечали государственными наградами, включая Сталинскую премию I степени. Говорят, что, когда академик умер от пневмоторакса в 1946 г. в возрасте 65 лет, Сталин воскликнул: «Вот жулик. Всех обманул!»
Воодушевившись, экспериментаторы приступили к поиску в крови омолаживающих молекулярных факторов. Множество ученых в других научных центрах, возбужденные этой публикацией, начали ставить аналогичные эксперименты, а самые предприимчивые организовали стартапы, сразу же продемонстрировавшие замечательные предварительные результаты.
Разочарование наступило, когда более корректно поставленные опыты показали, что в отношении целого организма все не так радужно: на продолжительности жизни старых мышей процедура не сказывалась, не менялись уровень гормонов и характеристики иммунной системы, по которым можно судить о возрасте. Молодые же мыши, получавшие кровь от старых, дряхлели и жили недолго – они явно страдали от чего-то, находившегося в старческой крови.
Критики обратили внимание на то, что сам по себе такой эксперимент в принципе не является простым обменом кровью. Во-первых, за счет общего кровотока здоровые органы молодой мыши – печень и почки – очищали весь поток крови от вредных веществ в качестве живого «аппарата» для гемодиализа. Во-вторых, объединенные кровотоком организмы обслуживались более мощной иммунной системой молодого животного. Наконец, кровь молодой мыши обеспечивала организм старой «хорошими» стволовыми клетками.
В целом омоложения не получилось, но стало ясно, что в крови старых животных содержится нечто вредное, а в крови молодых – нечто полезное, чего у старых не хватает. Детальные исследования состояния организма старых мышей после процедуры парабиоза показали, что в молодой крови действительно присутствуют какие-то факторы, которые стимулируют стволовые клетки в крови старых животных.
Ученые, ввязавшиеся в эти исследования, да еще и создавшие компании, поняли, что чудес не случилось, но есть надежда найти новые варианты терапевтических препаратов, если идентифицировать полезные и вредные вещества крови. Нужно только понять, чем отличается состав крови молодых и старых, и это будет пусть и не победа над старостью, но открытие реального пути продления здорового периода жизни человека.
Примером может служить компания Alkahest, основанная нейробиологом из Стэнфорда Т. Уисс-Кореем, которая работает над созданием средств для лечения болезней Альцгеймера, Паркинсона и послеоперационных нарушений работы мозга на основе фракций белков плазмы крови молодых доноров. Правда, убедительных данных о действенности такой плазмы против возрастных заболеваний пока нет.
Биотехнологи в поисках средств омоложения
Кандидатов на роль белков, избыток или недостаток которых негативно сказывается на состоянии организма, а коррекция концентрации может оказывать терапевтическое воздействие на стареющий организм, сегодня хватает.
Один из них – это белок TGF-β, количество которого в крови увеличивается при старении. Сообщалось, что нормализация уровня этого фактора в организме с помощью фармакологических препаратов способствует регенерации мышечной ткани и нервных волокон, оказывая благотворное действие на состояние старых животных.
Еще два белка, в больших концентрациях присутствующих в крови молодых, – THBS4 и SPARCL1 – благоприятно действуют на клетки мозга и могут тормозить процесс потери синапсов (контактов между нейронами или нейроном и эффекторной клеткой), характерный для ранних стадий нейродегенерации.
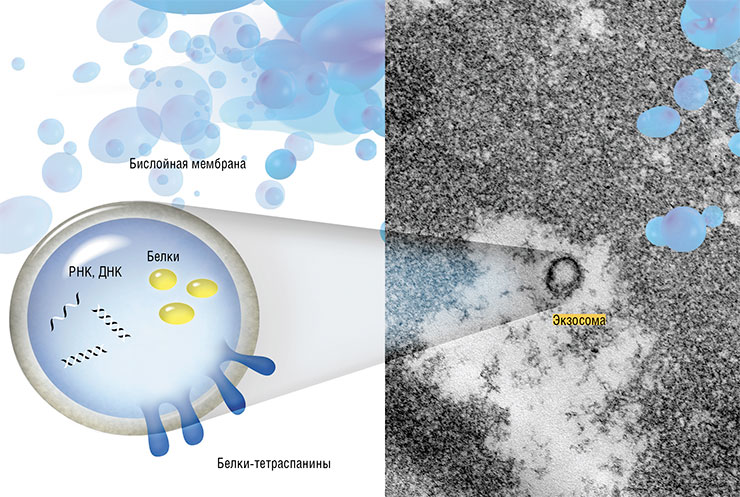
Коммуникация между клетками осуществляется с помощью транспортных пузырьков-экзосом, которые могут нести различные наборы РНК, белков и ДНК. Вверху справа – экзосомы из крови человека. Ультратонкий срез, просвечивающая электронная микроскопия. Фото Е. Рябчиковой (Новосибирск)
Компания Elevian в настоящее время исследует в качестве потенциального регенерирующего препарата белок GDF11, который также присутствует в повышенных количествах в «молодой» крови. По данным компании, он стимулирует рост сосудов в головном мозге, подавляет воспалительные процессы, улучшает регенерацию клеток мозга, сердца и мышц и может быть полезен для лечения таких возрастзависимых патологий, как инсульт и сахарный диабет.
В крови старых животных было зафиксировано падение концентраций белка остеопонтина, который стимулирует «пожилые» стволовые клетки, делая их «моложе» и активнее. На основе этого белка сейчас разрабатывается препарат для активации иммунной системы у пожилых людей.
А вот белок-хемокин CCL11 (эотаксин) с возрастом в крови, напротив, накапливается. С этим белком связывают развитие воспалительных процессов и таких заболеваний, как макулодистрофия – возрастное поражение сетчатки глаза. Специалисты из Alkahest разработали ингибитор эотаксина, и компания уже сообщила о положительных результатах второй стадии его клинических испытаний. Препарат особенно привлекателен тем, что применяется перорально, в то время как современные лекарства для лечения макулодистрофии требуют внутриглазного введения.

Интересные данные были получены при исследовании влияния на состав крови и возрастные нарушения в организме физических нагрузок. Давно подмечено, что повышенная физическая активность благоприятно сказывается на здоровье мозга и регенерации мышц вне зависимости от возраста. Сейчас ученые проверили, может ли этот эффект быть связан с изменением содержания в крови каких-либо белков.
В эксперименте плазму взрослых лабораторных мышей, которые много бегали, ввели мало двигавшимся особям того же возраста. Поразительно, но у мышей-реципиентов это привело к росту нейронов, улучшению памяти и обучаемости, а также к увеличению способности к регенерации мышечной ткани.
В крови самих «подвижных» мышей было отмечено повышенное содержание белка GPLD1, что характерно для молодых животных. Проверка показала, что выделенный чистый GPLD1 вызывает такие же эффекты, что и плазма мышей-«физкультурников».
GPLD1 – это фермент, синтезируемый в печени, который расщепляет гликолипид гликозилфосфатидилинозитол, находящийся на поверхности разных клеток крови и с которым, как с якорем, связывается много разных белков. В результате действия фермента поверхность клеток «очищается», что снижает интенсивность воспалительных процессов, которые лежат в основе развития нарушений функций того же мозга.
Из крови был выделен еще один белок, кластерин, обладающий аналогичным действием на организм. Он также присутствует в повышенных концентрациях у молодых и накапливается при физической нагрузке.
Эксперименты показали, что и у пожилых людей при повышенной физической активности концентрация GPLD1 в крови возрастает. Однако спорт пока не победил старость: хотя энергичные тренировки снижают интенсивность воспалительных процессов, которые происходят с возрастом в мышцах, старение в организме спортсменов не замедляется.Современные данные однозначно свидетельствуют, что ни о каком омоложении при переливании «молодой крови» говорить не приходится. Но одни люди хотят чудес, а другие знают, как на этом желании можно заработать.
В 2017 г. смелый и циничный предприниматель Д. Кармазин открыл в калифорнийском г. Монтерей компанию с броским названием Ambrosia, предлагающую переливать пожилым людям кровь молодых всего по 8 тыс. долларов за литр. Конечно же, американский государственный регулятор в здравоохранении – Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) – не смог не среагировать. Было выпущено официальное заявление о бездоказательности предлагаемого лечения и о небезопасности самой процедуры переливания крови.
После вмешательства FDA предприниматель поначалу испугался и закрыл свою компанию, но вскоре, несмотря на критику ученых и FDA, продолжил работу под новой вывеской Ivy Plasma, а позже возобновила работу и Ambrosia с филиалами в Сан-Франциско и Тампе. Кармазин заявил, что само переливание крови – процедура разрешенная, а он просто использует ее в других целях. Никаких исследований бизнесмен «на крови» проводить не собирается. Да и зачем? Дорого и долго. А клиенты идут и так. Всегда найдутся уверовавшие в чудеса «богатенькие Буратино», желающие омолодиться и готовые за это платить…
Недавние исследования привели ученых к мысли, что эффекты молодой крови могут вызываться не только присутствующими в ней белками, но и «переносчиками генетических программ» – экзосомами. Эти пузырьки-везикулы секретируются клетками и циркулируют в организме, перенося от одних клеток к другим РНК, белки и другие молекулы и таким образом регулируя клеточные функции в разных тканях.
Накопились свидетельства, что экзосомы могут переносить молекулы матричной РНК, которые способны «перепрограммировать» работу захватывающих их клеток.
Так, известно, что с возрастом у скелетных мышц снижаются способности к регенерации, а в крови параллельно падает численность экзосом, содержащих мРНК, на основе которой синтезируется белок Klotho. Этот белок важен для работы митохондрий, вырабатывающих энергию для регенерации стволовых клеток, которые производят новые клетки мышц. Снижение уровня Klotho с возрастом приводит к потере способности мышечной ткани залечивать повреждения, на месте которых образуются рубцы.
Оказалось, что если старым мышам ввести сыворотку крови молодых, содержащую экзосомы с мРНК, кодирующей Klotho, то повреждения мышечной ткани у них восстанавливаются лучше. Если же экзосомы не будут иметь в своем составе такую мРНК, процессы регенерации мышц не запустятся. Эти результаты подсказывают путь к созданию средств для лечения труднозаживающих, глубоких ран. А возможно, и не только их, ведь снижение уровня Klotho связано также с ухудшением здоровья мозга.
«Ножом и вилкой роем мы могилу себе»
Каждый знает, что неограниченный доступ к холодильнику чреват набором веса. Даже когда люди не голодны, они не прочь что-нибудь съесть, зачастую даже не осознавая этого. Кто-то ест лишнее из-за стресса, кто-то – «просто так», от скуки или по привычке.
Лабораторные мыши в этом отношении похожи на людей. Обычно корм им дают без ограничений, чтобы не заботиться о кормлении по часам и граммам. И грызуны переедают: еще в первой половине прошлого века было установлено, что порцию им можно урезать на 10–40 % без всякого вреда для здоровья. Тогда же обнаружилось, что если мышам давать меньше корма (конечно, не доводя до дефицита питательных веществ и витаминов), то они живут дольше. Срок увеличения продолжительности жизни зависит от многих факторов, большой разброс наблюдается даже среди генетически идентичных животных, но в среднем составляет 30–50 % (!).
Казалось бы, вот он, рецепт долголетия: есть меньше! Увы, мыши – это не люди, живут они мало, стареют быстро, и нет уверенности, что человек получит в награду дополнительные полжизни, промучившись все это время на голодной диете. Пока самый близкий к человеку вид, для которого есть хоть какие-то данные относительно такого «лечебного голодания», – это макаки-резусы, которые живут в среднем 25 лет. В долговременном эксперименте было показано, что ограничение потребления пищи у этих приматов снижает риск смертности в любом возрасте примерно вдвое, что в пересчете на добавленные годы жизни составляет 6–7 лет. Неплохо, но до мышей далеко.
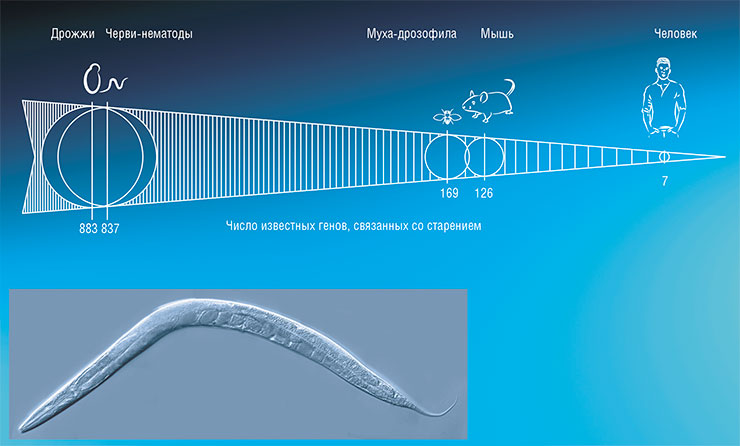
Согласно данным базы GenAge, для дрожжей и нематод известно несколько сотен генов, функция которых связана со старением. Для человека число таких генов не превышает десятка. По: (de Magalhães, Stevens, Thornton, 2017). Внизу – нематода Caenorhabditis elegans. © CC BY-SA 2.5/ Kbradnam
Для человека подобный эксперимент невозможен, и не только по этическим причинам: он займет никак не меньше сотни лет. Вот если бы в опытах на животных установить сам механизм лечебного голодания, да на этой основе сделать таблетку…
В начале 1990‑х гг. американская исследовательница С. Кеньон вела поиск генов, увеличивающих срок жизни крохотных червей-нематод Caenorhabditis elegans – излюбленного объекта биологии развития, на котором были открыты многие молекулярные механизмы дифференцировки клеток. В норме эти животные живут около 3 недель, поэтому изучать долгожительство на них не в пример удобнее, чем на мышах.
Но, как это часто бывает в науке, все пошло не по плану. Из практических соображений Кеньон собиралась проводить эксперимент на червях с мутацией в гене daf‑2, которых можно долго содержать в виде мелких личинок – это не мешает видеть под микроскопом долгоживущих взрослых особей. Но задуманный эксперимент даже не пришлось начинать: к удивлению ученого, черви daf‑2 жили вдвое дольше обычных без всякого вмешательства!
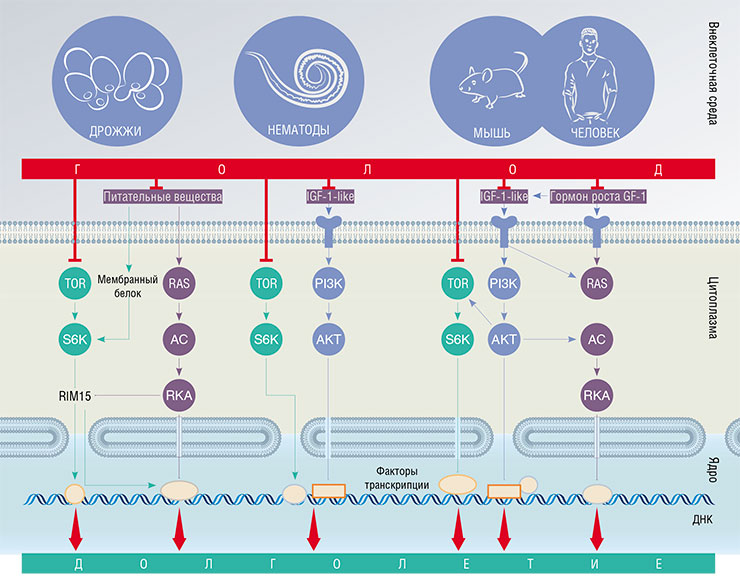
Ряд генов, влияющих на продолжительность жизни, связан с сигнальными путями, отвечающими за производство энергии и клеточный рост. Если клетка «чувствует» много еды вокруг, либо напрямую, как у дрожжей, либо при помощи сигнальных молекул, как у червей и млекопитающих, то в ней активируются внутриклеточные сигнальные пути: IGF-1, mTOR, RAS/AC/PKA. Это, с одной стороны, подталкивает клетку к росту и делению, с другой – вызывает задержку в цитоплазме некоторых белковых факторов транскрипции, контролирующих процесс синтеза РНК на матрице ДНК. Если питательных веществ мало, то эти сигнальные пути «молчат», а факторы транскрипции идут в ядро клетки, где активируют гены, ответственные за восстановление повреждений биомолекул и рациональное использование ресурсов. По: (Fontana, Partridge, Longo, 2010)
В течение нескольких лет Кеньон и ее коллеги из других лабораторий идентифицировали несколько генов, регулирующих срок жизни C. elegans. Все они оказались связаны с сигнальным путем, реагирующим на присутствие в окружающей среде углеводов, аминокислот, холестерина, кислорода и других веществ, необходимых для роста клетки и производства энергии. Создается впечатление, что в богатой среде клетки интенсивно делятся, и организм инвестирует ресурсы в производство потомства. А в бедной – переходит в «режим энергосбережения», направляя все имеющиеся небольшие ресурсы на поддержание себя самого, в надежде, что условия в будущем улучшатся.
У человека все эти процессы регулируются известными гормонами – инсулином и инсулиноподобным фактором роста (IGF‑1), а у нематод ген daf‑2 кодирует клеточный рецептор все того же IGF‑1. Но не все так просто: напрямую влиять на этот путь нельзя без огромного риска для здоровья. И вопрос «таблетки долголетия» оставался открытым, пока опять на помощь не пришел счастливый случай.
В 1975 г. микробиолог С. Сегал из небольшой канадской фармацевтической фирмы Ayerst Research Laboratories выделил из образца почвы с о. Пасхи штамм бактерий стрептомицетов, продуцирующий новый антибиотик, который был назван рапамицином по названию острова на местном языке (Рапануи). Сначала рапамицин попытались использовать как противогрибковое средство, но этому помешала его высокая токсичность для иммунной системы. Но зато с конца 1990‑х гг. под новым названием сиролимус он получил признание как эффективный иммуносупрессор для предотвращения отторжения пересаженных органов.

Эта мемориальная доска на о. Пасхи (Рапа-Нуи) посвящена открытию нового лечебного средства рапамицина (сиролимуса) и является данью уважения от бразильских ученых. Табличка, написанная на португальском языке, гласит: «В этом месте в январе 1965 г. были получены образцы почвы, которые позволили получить рапамицин – вещество, открывшее новую эру для пациентов, перенесших трансплантацию органов». Мишенью рапамицина у млекопитающих является белок mTOR, ключевой регулятор клеточного энергетического баланса. Слева – рапамицин в комплексе с белком FKBP12 взаимодействует с соответствующим доменом (элементом третичной структуры белка) mTOR. Public Domain
Попав в клетку, рапамицин связывается с небольшим белком FKBP, и этот комплекс подавляет активность белка mTOR – ключевого регулятора энергетического баланса клетки. Для деления клетки и синтеза всех ее новых компонентов требуется много энергии, поэтому если mTOR неактивен, то клетка «разрешения» на деление не получает и продолжает жить и расти в надежде поделиться когда-нибудь позже. Уже видны аналогии с червями Кеньон?
Путь mTOR – это своего рода надзиратель за путем IGF‑1, и его ингибирование на молекулярном уровне оказывает такое же действие, как и голодание: организм включает режим самоподдержания и экономии энергии. Мыши с неограниченным доступом к еде, регулярно получающие рапамицин, также живут на 30–50 % дольше, а биохимический статус их клеток показывает более высокую способность к регенерации.
Похожим образом действует и препарат метформин, обычно применяемый для лечения диабета 2‑го типа: он заметно увеличивает продолжительность жизни мышей и тормозит развитие у них опухолей. Пожилые пациенты-диабетики, принимающие метформин, демонстрируют лучшую выживаемость по сравнению с пациентами на других препаратах. Конечно, в этом случае речь идет скорее о защите от преждевременной смерти в результате заболевания, а не о замедлении старения.
А теперь совет: не спешите глотать рапамицин – помните о его токсичности. К тому же разработки следующих поколений ингибиторов mTOR активно продолжаются. Понимание же, что старение, возможно, контролируется на генетическом уровне, поставило следующий вопрос: можно ли для долголетия отредактировать геном?
Редактируем геном?
Инструментов воздействия на геном сейчас много. Борцы со старением воодушевились возможностями генетических технологий, которые позволяют, пусть пока и не очень эффективно и избирательно, доставлять в геном человеческих клеток определенные гены или регулировать работу уже имеющихся.

Ведь как было бы здорово, если бы получилось внедрить в организм какой-нибудь «ген долголетия», кодирующий нужный белок, или «выключить» ген, ускоряющий старение. Для долгой и здоровой старости можно было бы исправлять на генном уровне болезни пожилого возраста: многие попытки генной терапии, к примеру, направлены на то, чтобы «подправить» метаболизм липидов для снижения риска развития атеросклероза.
В сравнении с другими подходами к продлению жизни генную терапию достаточно провести только один раз. С другой стороны, она необратима – ошибка здесь в прямом смысле ценою в жизнь, поэтому генная терапия на уровне эмбрионов для человека пока запрещена во всем мире, а изменить гены у взрослого организма – задача гораздо более сложная.
Разумеется, и тут ученые сначала тренируются на мышах: для тех же путей IGF‑1 и mTOR получены около 20 линий с разными изменениями в разных генах, однако наилучший результат удлинения жизни пока равен 30 %, тогда как в некоторых других случаях животные, напротив, болеют и рано умирают.
Внимание генных терапевтов, естественно, привлекли теломеры. Американская компания BioViva разработала векторы-переносчики на основе цитомегаловируса для внесения в различные клетки взрослого (пока что мышиного) организма генетических конструкций, способствующих удлинению теломер. При введении в клетки гена, кодирующего фермент теломеразу, у животных значительно улучшалась толерантность к глюкозе, физическая активность, они не лысели и не теряли массу тела в старости, а средняя продолжительность жизни увеличивалась на 40 %.
Специалистам компании удалось доставить в клетки мышей гены, кодирующие и другие белки: уже упоминавшегося Klotho, что помогло удлинить жизнь животных на 20–30 % в зависимости от пола (самцам повезло больше), а также фоллистатина. Как известно, фоллистатин ингибирует белок миостатин, который препятствует росту мышц и способствует дегенерации мускулатуры в старости, что снижает качество жизни и увеличивает риск смертности. И мыши с повышенным производством фоллистатина жили на треть дольше.
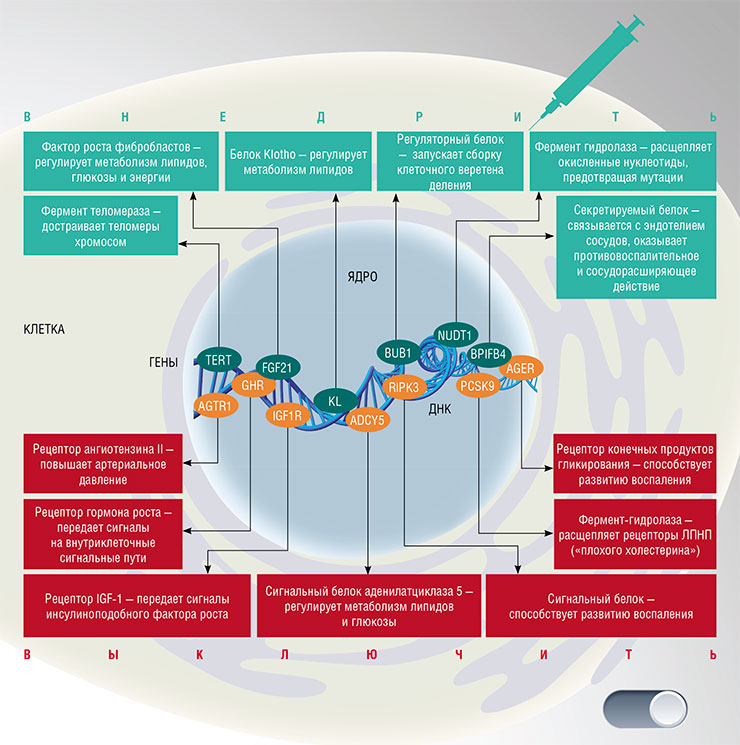
Генотерапия теоретически позволяет доставить в организм человека «ген долголетия» или «выключить» ген, ускоряющий старение. Пока же ученые пробуют этот подход на лабораторных мышах, и не всегда успешно. Вверху – примеры генов, кодирующих важные для здоровья белковые продукты, которые уже были испытаны в качестве терапевтических мишеней на животных с целью увеличения продолжительности жизни
Возглавляющая компанию Э. Пэрриш в апреле 2016 г. наделала много шума, объявив о проведенном над собой эксперименте. Женщине были введены генно-инженерные препараты фоллистатина и теломеразы, для чего ей пришлось съездить в Колумбию, поскольку FDA не дало разрешения на такую операцию в США. Итоги пока не впечатляют: судя по изображениям Пэрриш «до и после», омоложение достигнуто косметикой и фотошопом, а заявленное компанией увеличение длины теломер в ее лейкоцитах находится в пределах стандартной экспериментальной ошибки.
Так что пока все разговоры об этих «генетических фармпрепаратах» для человека не подтверждены реальными результатами, а сама компания подвергается критике за явное введение публики в заблуждение.
Большие надежды в генной терапии старения сейчас возлагают на еще один ген – BPIFB4. Интерес этот связан с тем, что один из его вариантов гораздо чаще встречается у долгожителей, чем в среднем в человеческой популяции.
Этот генный вариант кодирует белок, у которого аминокислота изолейцин в позиции 229 заменена на валин. Механизм действия этой замены непонятен, но оказалось, что введение с помощью вирусных векторов этого гена стареющим мышам с гипертонией и сердечными заболеваниями останавливает ухудшение функций миокарда и смягчает воспалительные реакции. Сейчас BPIFB4 рассматривается как реальный кандидат генно-инженерного лекарства для лечения атеросклероза, нейродегенеративных и сердечно-сосудистых заболеваний.
Волшебные факторы профессора Яманаки
Но обязательно ли для омоложения на клеточном уровне доставлять в организм новые гены, да и вообще вносить какие-либо изменения в сам геном? Ведь уже почти 20 лет существуют технологии репрограммирования «взрослых» клеток в стволовые, которые открыли широкие возможности для развития иных терапевтических подходов. Может быть, имеет смысл просто взять клетки человека, превратить их в стволовые и использовать для регенерации изношенных органов и тканей?
Все началось в 2006 г., когда японский профессор С. Яманака обнаружил, что с помощью четырех белков, регулирующих экспрессию генов, – Oct4, c-Myc, Sox2 и Klf4 – можно превратить обычные клетки в так называемые плюрипотентные стволовые клетки. Их замечательные свойства состоят в том, что они могут делиться бесконечно и дифференцироваться в различные виды специализированных клеток, восстанавливая поврежденные ткани. Это открывает путь лечения заболеваний, в основе которых лежит клеточное старение: нейродегенерации, потери слуха, дистрофии сетчатки, остеопороза, сердечно-сосудистых заболеваний, недостаточности функций почек и легких и многих других.
На сегодня наиболее реальной выглядит процедура, когда обычные дифференцированные клетки, взятые у пожилого человека, перепрограммируют в стволовые и выращивают из них «молодой» орган или ткань, которые пересаживают обратно пациенту. Но есть проблема: оказавшись в окружении старческих клеток, такие клетки сами быстро стареют. Напрямую же вводить человеку плюрипотентные стволовые клетки опасно: из-за высокой способности к делению они могут спровоцировать развитие опухолей.
Однако оказалось, что этой угрозы можно избежать, если применять модифицированный «коктейль Яманаки» без белка c-Myc, что позволяет вернуть специализированные клетки в плюрипотентное состояние лишь частично, без потери своей идентичности. С помощью такого неполного репрограммирования можно воздействовать на определенные органы без глобальной опасности для организма.
В опытах на животных с помощью такого коктейля удалось на 40 % продлить жизнь короткоживущим мышам, больным прогерией. С помощью частичного репрограммирования также удалось восстановить у мышей поврежденный оптический нерв. Кстати сказать, офтальмология – это одна из самых перспективных областей для медицинских геномных и клеточных технологий, потому что терапию здесь можно проводить локально, не затрагивая весь организм.
Ученые, работающие в области применения стволовых клеток, обычно позиционируют это как новый подход в терапии заболеваний, а не как метод возвращения молодости. Пожалуй, наиболее известная компания, работающая в этой области, – калифорнийская Altos Labs, созданная Ю. Б. Мильнером, бывшим советским физиком и предпринимателем, а ныне американским бизнесменом, и Д. Безосом, одним из самых богатых людей в мире.
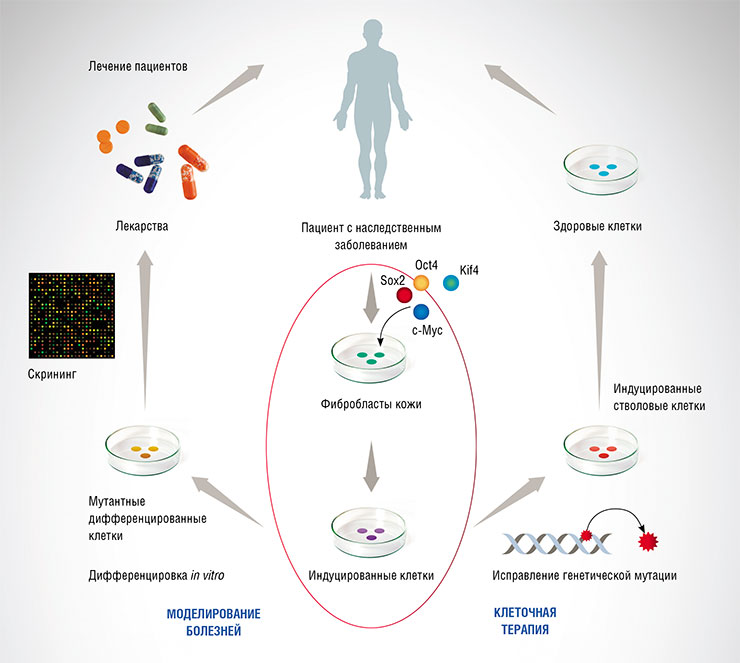
Практические приложения технологии индуцированных плюрипотентных стволовых клеток (ИПСК): скрининг химических веществ с целью поиска лекарств и исправление мутаций с последующей трансплантацией «излеченных» клеток человеку. По: (Некрасов и др., 2014)
Фирма разрабатывает технологии, основанные на частичном перепрограммировании клеток для лечения «возрастных» заболеваний и продления здоровой жизни людей. В ней ведутся как фундаментальные, так и прикладные исследования, а в ее проектах участвуют самые выдающиеся ученые, лауреаты Нобелевской премии: сам Яманака, Д. Даудна – первооткрывательница технологии генетического редактирования CRISPR/Cas9, а также Ф. Арнольд – специалист в области белковой инженерии, разработавшая принцип эволюции ферментов in vitro.
Altos Labs планирует с помощью новых методов остановить развитие ряда возрастзависимых заболеваний, что, возможно, позволит на полвека удлинить человеческую жизнь.
Эпигенетика: новая надежда на омоложение
Новые надежды на создание подходов для противодействия возрастным изменениям возникли и в связи с исследованиями регуляции генов. Ведь при перепрограммировании клеток их геном не меняется – в нем происходят лишь долговременные и стабильные изменения в активности большого набора генов. Изучением природы таких изменений занимается бурно развивающаяся в последние годы область молекулярной биологии – эпигенетика.
Регуляция активности (экспрессии) генов в значительной мере осуществляется за счет метилирования азотистых оснований ДНК в определенных участках генома. Если нужно ввести в ДНК «эпигенетическую метку», то к обычному нуклеотиду цитозину (C) специальные ферменты ДНК-метилтрансферазы добавляют метильную группу (–CH3) – получается 5‑метилцитозин (mC). Но для этой операции годятся не любые цитозины, а только те, что стоят в ДНК рядом с другим нуклеотидом – гуанином (G) (такие «двухбуквенные» сочетания называют CpG-динуклеотидами).
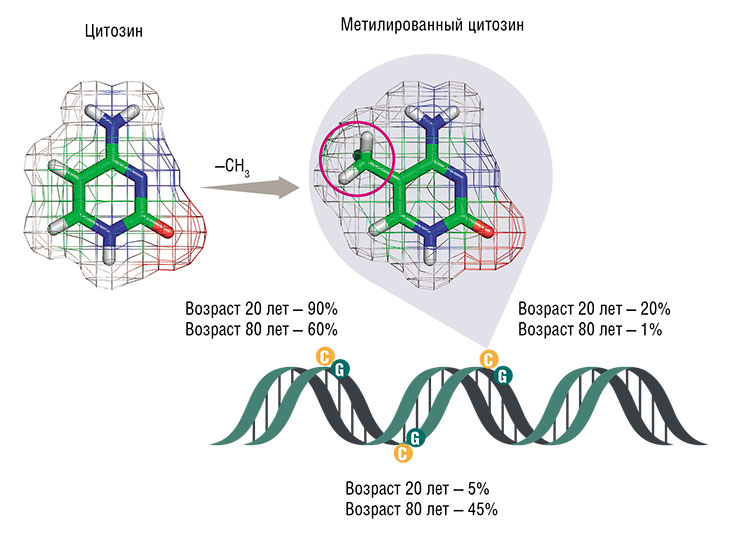
В геноме человека много (около 28 млн) CpG-сайтов, где цитозин может подвергаться метилированию. По уровню метилирования цитозинов в определенных критических местах генома можно с довольно большой точностью определить хронологический возраст. По: (Underlying Features of Epigenetic Aging Clocks | Morgan Levine, Yale University)
С метилированными CpG-динуклеотидами связываются специальные белки-«чтецы», которые могут, к примеру, превратить ДНК в плотный, слабоактивный гетерохроматин либо, напротив, облегчить узнавание участков, с которых начинает «считываться» ген, таким образом его активируя.
«Стирание» эпигенетических меток обеспечивают другие ферменты – белки семейства TET, которые окисляют метильную группу. Кстати, с возрастом уровень одного из этих белков, TET2, снижается в гиппокампе – области мозга, ответственной за формирование памяти. Если заблокировать активность гена Tet2 в гиппокампе молодых мышей, то рост нейронов затормаживается, у животных ухудшается память и способность к обучению. У взрослых же мышей повышение концентрации белка TET2 в гиппокампе улучшает нейрогенез и память.
Таким образом, хотя все клетки организма имеют одинаковый геном, каждая из них характеризуется своим «эпигенетическим ландшафтом» – набором меток в ДНК и связанных с ней белках.
В 2013 г. американский генетик С. Хорват из Калифорнийского университета в Лос-Анджелесе сообщил о создании первых эпигенетических часов. Проанализировав данные биоинформатических баз, касающиеся метилирования ДНК в 8 тыс. образцах здоровых органов и тканей человека, он составил подборку из 353 CpG-сайтов, метилирование которых очень сильно коррелирует с биологическим возрастом. В каких-то из них метилирование со временем снижается, в каких-то увеличивается. При использовании всего этого набора Хорвату удалось предсказывать биологический возраст человека с точностью до трех с половиной лет независимо от того, из какого органа происходила анализируемая ДНК.
Интересно, что тот же набор предсказательных маркеров работает и для нашего близкого родственника – шимпанзе! А еще интереснее то, что эпигенетические часы Хорвата показывают «нулевой» возраст у стволовых клеток, как эмбриональных, так и индуцированных, а вот для раковых диагностируют ускоренное (на 30–40 лет) старение по сравнению со всем организмом.
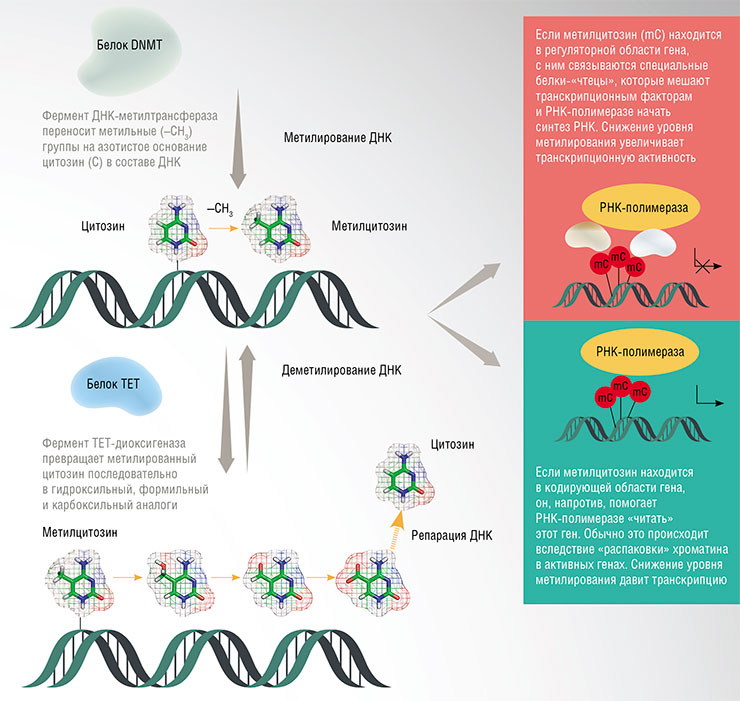
Такие эпигенетические модификации ДНК, как метилирование цитозина, происходят с участием белка ДНК-метилтрансфераза (DNMT), который забирает метильную группу у метаболита S-аденозилметионина (SAM). Убрать эпигенетическую метку помогает белок TET, который окисляет метилцитозин (MeC) в несколько шагов. На конечной стадии, при помощи еще нескольких белков, цитозин восстанавливается. По: (Russell-Hallinan, Watson, O’Dwyer et al., 2021)
За прошедшее десятилетие калибровка эпигенетических часов улучшилась за счет добавления новых маркеров и учета дополнительных факторов, влияющих на метилирование, таких как курение и уровень сахара в крови. Остается открытым вопрос: связано ли изменение активности генов, в которых находятся маркеры эпигенетических часов, с механизмом самого процесса старения? Или они являются простым отражением глобальных процессов в организме?
Несколько генов из числа тех, что использовал Хорват, действительно могут быть связаны со старением на причинно-следственном уровне. Например, ген SMC4, кодирующий белок конденсин, важный для правильной упаковки хромосом при клеточном делении, а также ген CD46, продукт которого является одним из ключевых регуляторов иммунных процессов. Недостаток этих белков в результате нарушения эпигенетической регуляции может вносить вклад в патологические процессы, характерные для старения.
Однако большинство CpG-маркеров эпигенетических часов расположены в местах генома, для которых такие функции неизвестны. Так что изменение их метилирования с возрастом вызвано, скорее всего, общим дисбалансом системы эпигенетической регуляции.
Что может служить причиной подобной разбалансировки? Предположений на этот счет множество. Сравнительно недавняя, но достаточно убедительная гипотеза считает главным виновником систему репарации ДНК. На первый взгляд это кажется странным, ведь репарация ДНК, по идее, должна, наоборот, поддерживать геном в неповрежденном состоянии. Однако репарация всегда сопровождается ремоделированием («переупаковкой») клеточного хроматина, чтобы открыть белковым факторам репарации доступ к повреждению. И если повреждения возникают часто, то даже при точной репарации хроматин не всегда успевает возвратиться к нормальному состоянию, эпигенетические отклонения накапливаются, и клетка стареет.
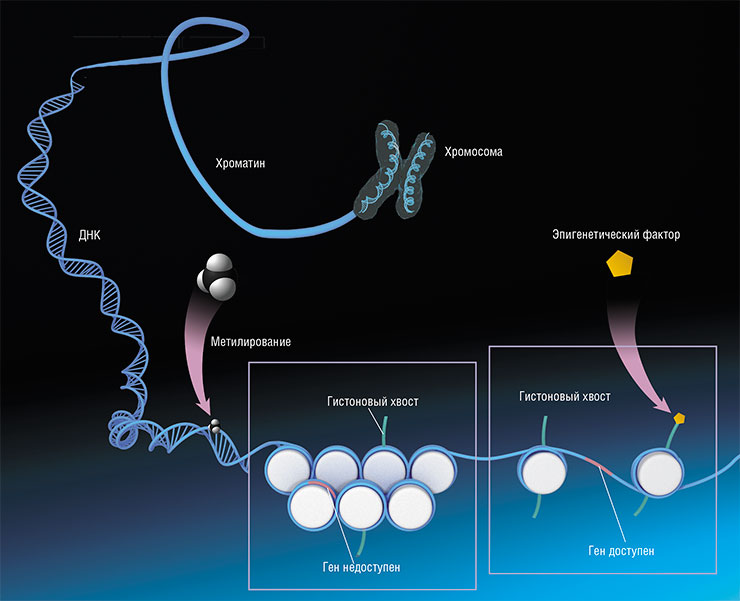
Есть и другой способ эпигенетической регуляции активности генов, помимо метилирования цитозина. Он заключается во внесении модификаций в белки-гистоны, на которые, как на катушку, намотана ДНК в ядре клетки. Чем плотнее упаковка в «катушке», тем труднее получить доступ к ДНК ферментам, синтезирующим РНК с матрицы ДНК. Поэтому в области плотной упаковки гены будут неактивны. Эпигенетическая модификация гистонов может способствовать более свободному расположению «катушек», в результате чего доступ к этому участку ДНК облегчается. По: (Жарков, 2017)
Это предположение подтверждают работы американских ученых из Гарвардской медицинской школы, недавно создавших линию трансгенных мышей, у которых постоянно происходят разрывы ДНК. Эти разрывы безошибочно исправляются, не оставляя после себя мутаций, но животные ускоренно стареют: седеют, худеют, теряют память и способность к обучению; у них слабеют мышцы, снижается плотность костей и отказывают почки – в общем, все как у пожилых людей.
Но когда ученые заразили таких мышей специально сконструированным вирусом, который перенес в их клетки гены Oct4, Sox2 и Klf4, кодирующие три из четырех факторов Яманаки, многие из этих возрастных изменений обратились вспять. Тут, кстати, можно опять вспомнить о ретротранспозонах: при встраивании в геном они вносят в него разрывы, и именно это, возможно, определяет их роль в старении клеток.
Постаревшие клетки – враги или друзья?
Как уже было сказано, подавляющая часть клеток нашего организма не делится, но спокойно живет и работает, выполняя свои функции, а для обновления тканей и органов существует небольшое количество стволовых клеток. Однако со временем в неделящихся клетках накапливаются повреждения и изменения. Многие состарившиеся (сенильные) клетки начинают активно секретировать белки-регуляторы иммунного ответа: провоспалительные цитокины, факторы роста, ферменты-протеазы, а кроме того, экзосомы, микроРНК и фрагменты ДНК.
В норме все это нужно для того, чтобы иммунная система ликвидировала сенильные клетки и они заместились новыми. Сенильные клетки сами не погибают, потому что у них заблокирован механизм апоптоза – клеточного «самоубийства». Если же эти клетки не уничтожить, то вещества, секретируемые сенильными клетками, могут принести вред окружающим тканям.

Долгожителей можно найти среди людей разной расы, национальности, социального статуса, места и образа жизни. К примеру, эта пожилая женщина (слева) – из китайской деревушки Мае Салонг, расположенной в живописной долине на севере Таиланда. Долгожителем была и королева Великобритании Елизавета II, правившая страной в течение 70 лет. К моменту смерти в возрасте 96 лет она являлась самым долгоправящим и старейшим монархом в британской истории, а также самым долгоправящим и старейшим главой государства в мире. © CC BY-NC-ND 2.0/Eric Montfort и © CC BY 4.0/ Julian Calder
С возрастом иммунная система слабеет, и сенильные клетки продолжают свое существование. Активность генов у них регулируется все хуже из-за разрушения эпигенетического ландшафта; в стареющих клетках появляются ассоциированные со старением белки (например, β-галактозидаза), а накопленные мутации могут вновь активировать деление и отправить клетку на онкогенный путь…Удивительно, но стареющие клетки могут участвовать в физиологической регенерации (восстановлении структуры и функций тканей и органов) благодаря способности воздействовать на процессы, имеющие отношение к перепрограммированию клеток и приобретению ими свойств недифференцированных стволовых.
Так, у тритонов и саламандр, способных за несколько недель восстановить утерянный хвост или конечность, на ключевых стадиях регенерации в ткани культи и в бластеме (совокупности клеток, из которой в дальнейшем формируются все ткани новой конечности) увеличивается численность стареющих клеток. Эти клетки стимулируют дедифференцировку клеток ткани культи, секретируя сигнальные молекулы, которые заставляют клетки зрелых мышечных волокон превращаться в клетки-предшественники. Как выяснилось, эти вещества стимулируют работу сигнальных путей WNT и FGF, участвующих во многих важных клеточных процессах, включая процессы развития (Walters et al., 2023)
Очевиден вывод, что накопление сенильных клеток играет заметную роль в развитии возрастных заболеваний. Хотя нужно отметить, что их функции на сегодня не вполне изучены. Такие клетки обнаруживаются в некоторых количествах и в молодых организмах, и даже в эмбрионах, где участвуют в формировании органов (конечностей, почек, внутреннего уха), требующем масштабного ремоделирования тканей. Предполагается даже, что чем дольше живут животные разных видов, тем больше их клетки склонны к старению – чтобы защититься от мутаций.
Над созданием препаратов-сенолитиков, способных уничтожать стареющие клетки, сейчас работают много исследователей. В одном эксперименте ученые ввели мышам противоопухолевые препараты, разблокирующие апоптоз: дазатиниб и флавоноид кверцитин. Дазатиниб убивает стареющие клетки-«родоначальники» жировой ткани человека, а кверцитин – эндотелиальные клетки-предшественники костного мозга. Комбинация этих двух препаратов дает повышенную сенолитическую активность.
В результате подопытные животные прожили на 36 % дольше, чем контрольные мыши. Дальнейшие исследования показали, что сенолитики уменьшают риск развития таких функциональных нарушений, как ожирение, атеросклеротическое поражение сосудов и остеопороз. Правда, возрастные изменения памяти, мышечной силы и координации движений оставались у них прежними, т. е. удаление стареющих клеток избавило животных лишь от некоторых старческих немощей.
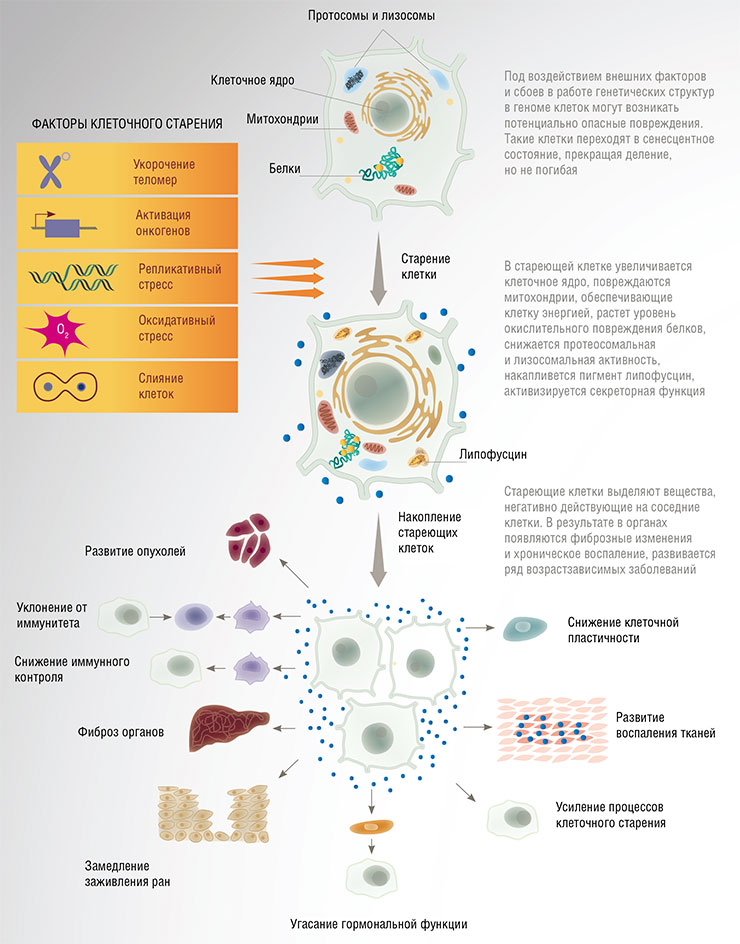
Один из типов повреждений, ответственных за появление возрастных заболеваний и старение в целом, – это переход нормальных клеток в сенесцентное (стареющее) состояние. Обычно такие клетки уничтожаются либо с помощью механизма апоптоза (самоликвидации), либо в результате активации иммунной системы. Однако с возрастом иммунная система человека работает все менее эффективно, не обеспечивая быстрого удаления стареющих клеток. Такие клетки приобретают «старческий секреторный фенотип» (SASP, senescence associated secretory phenotype), начиная выделять биологически активные факторы (цитокины, хемокины, протеазы, ростовые факторы и т. д.). Все они вызывают воспаление и изменения во внеклеточном матриксе и отрицательно влияют не только на клетки микроокружения, но и на организм в целом, провоцируя развитие таких «возрастных» патологий, как сахарный диабет, ревматоидный артрит, остеопороз, нейродегенеративные, сердечно-сосудистые и онкологические болезни
Дальше всех в создании терапевтических сенолитиков продвинулась американская компания Unity Biotechnology. Ее препарат UBX 1325 для лечения диабетической ретинопатии (осложнения сахарного диабета, ведущего к слепоте) находится уже на второй фазе клинических испытаний. При этом заболевании из-за накопления сенильных клеток в стенках глазных капилляров кровь подтекает в центральную часть сетчатки, которая набухает, и это нарушает зрение. UBX 1325 подавляет функции белка Bcl-xL, препятствующего апоптозу, который в изобилии производится в патологически измененных сосудах сетчатки.
Клинические испытания показали, что у пациентов, получивших инъекцию UBX 1325, зрение существенно улучшалось. К сожалению, этот препарат, как и противоопухолевые препараты, действующие на уровне регуляции апоптоза, не очень избирателен и поражает не только сенильные, но и нормальные клетки.
Чтобы получить более совершенные препараты-сенолитики второго поколения, нужно повысить избирательность их действия. Для этого ученые ищут молекулярные мишени, характерные именно для сенильных клеток, например, активно работающие ферменты и генетические программы, поверхностные белки и т. п.
Среди перспективных средств – антитела, узнающие поверхностные белки стареющих клеток и способствующие их уничтожению иммунной системой. Примером может служить моноклональное антитело STX255 от испанской компании Senolytic Therapeutics. Это антитело связывается с белком PD-L2, который в больших количествах присутствует на поверхности стареющих клеток, «маскируя» их от иммунной системы. Ингибирование этого белка позволяет иммунным клеткам атаковать сенильные.

Еще один подходящий для воздействия поверхностный белок – GPNMB (гликопротеин B неметастатической меланомы), который часто встречается на поверхности различных раковых клеток, а также активно синтезируется в стареющих клетках эндотелиальной выстилки кровеносных сосудов и в лейкоцитах. В экспериментах антитела против этого белка замедляли старение аорты и увеличивали продолжительность жизни мышей с атеросклерозом.
Удобной биологической мишенью служит и белок FOXO4, подавляющий апоптоз, который также интенсивно синтезируется в сенильных клетках. Препараты, способные связываться с этим белком и разблокировать апоптоз, продляли жизнь мышей на 13 %.
Один из остроумных способов уничтожения сенильных клеток использует упомянутый выше фермент β-галактозидазу, который накапливается в таких клетках. Было синтезировано соединение, которое под действием этого фермента высвобождает токсичный для клеток нуклеотид 5‑фторуридин. Мыши с прогерией, получавшие этот препарат, жили на 40 % дольше контрольных, у них медленнее шло характерное для старения снижение выносливости, мышечной силы и функций стволовых клеток.
Нужно отметить, что уже начались работы и по созданию еще более сложных препаратов-сеноморфиков, которые не убивают стареющие клетки, а изменяют их свойства, воздействуя на специфические функционирующие у них генетические программы. К таким соединениям относятся антисмысловые олигонуклеотиды и малые интерферирующие РНК.
Подобные препараты планируется использовать для лечения широкого спектра заболеваний, включая нейродегенеративные, аутоиммунные, остеоартрит, старение кожи и др. С их помощью можно будет также удалять сенильные клетки, появившиеся в результате химиотерапии рака, которые в дальнейшем могут приводить к рецидивам онкологического заболевания.
И, конечно, надо понимать, что рекламные заявления компаний и интервью ученых о волшебных сенолитиках, как и о других препаратах для борьбы с возрастными изменениями, не вполне соответствуют действительности. Объективную оценку ситуации дать трудно: большинство компаний проводит исследования в условиях секретности и их сообщениям об успехах приходится верить на слово.
На сегодня все надежды на устранение сенильных клеток как способ улучшения здоровья вытекают из опытов на мышах, а результаты небольшого числа клинических испытаний пока не оправдали ожиданий. Однако основания верить в перспективность этих препаратов есть: пусть даже они и не победят «старость вообще», но могут помочь в лечении заболеваний, поражающих не только пожилых, но и молодых.
Ворох проблем
«Таблетка от старости» должна действовать на всю большую группу возрастных изменений, между которыми трудно найти что-то общее. Ведь воздействие на какие-то конкретные мишени может и не дать нужного результата: замедлим один процесс, будем стареть от другого. Хорошо бы найти главный управляющий узел генов, воздействие на который оказало бы влияние на все негативные процессы, ведущие к старению. Но есть ли он вообще?
Вспомним про эволюцию. Если бы даже существовал единственный основной механизм управления старением, организмы все равно столкнулись бы с последствиями вредных мутаций, проявляющихся на поздних годах жизни – когда естественный отбор почти не действует. Эти мутации могут быть совершенно разного рода, а отсюда следует, что исправление «ограничителей» продолжительности жизни потребует вмешательства сразу во много точек. Так что перспективы изобрести простой способ достичь максимальной продолжительности жизни выглядят сомнительными.
Вне зависимости от того, действуем ли мы на главный регулятор или на конкретный процесс, можно рассмотреть две стратегии для продления жизни: превентивное воздействие (геропротекторы) или репаративное вмешательство (геротерапевтики).
Превентивные меры могут замедлить скорость накопления повреждений, но не способны полностью остановить этот процесс. Как мы помним из закона Гомпертца – Мейкхама, старение протекает с ускорением. Объяснить это можно возникновением сбоев в работе систем контроля: репарации ДНК, утилизации поврежденных клеточных органелл (аутофагии), апоптоза и иммунитета. С течением времени эти системы начинают работать хуже, что облегчает дальнейшие повреждения. Процесс будет ускоряться экспоненциально, и исходное замедление геропротекторами не спасает ситуацию.
Таким образом, хотя превентивные меры и могут быть полезны, все равно необходимо сохранять и усиливать системы репарации широкого спектра возможных повреждений.
Ученые любят сообщать о своих победах, а журналисты любят сенсации. Так и возникают броские заголовки: «Ожидается создание эффективных геропротекторов для человека!», «С помощью нового подхода увеличили жизнь червям в 10 раз!»
В действительности же радоваться могут разве что червяки. Перенос результатов многих опытов с животных на человека не обоснован. Например, путем воздействия на ген age‑1, работающий в сигнальном пути IGF‑1, действительно удалось увеличить продолжительность жизни нематоды C. elegans с 3 недель до 230 дней. Однако такое влияние на тот же ген у мышей одной генетической линии продлило их жизнь на 270 дней, а другой линии – наоборот, сократило.
Люди от червей эволюционно еще дальше, чем мыши, да и от мышей мы заметно отличаемся. К примеру, наша иммунная система и мозг работают иначе, так что полноценного моделирования нейродегенеративных заболеваний на мышах не получится. Человек и мышь могут по-разному отвечать и на удаление сенильных клеток.
Еще одна тонкость: при испытаниях потенциальных геропротекторов ученые любят использовать прогероидных, быстро стареющих мышей. Но это не нормальные, а больные животные, их жизнь продлевается за счет улучшения состояния здоровья, а не потому, что старость отступила. И достигаемое в таких опытах удлинение жизни на 20–45 % – не повод для восторга.
Так что при всем добром отношении к крысам, мышам и нашим дорогим друзьям собакам их организмы не идентичны человеческому. Есть лекарства, успешно использующиеся для лечения людей, которые убивают собак. И наоборот, множество препаратов, успешно прошедших испытания на животных, оказываются неприменимыми для лечения человека. Достаточно вспомнить историю с седативным препаратом талидомидом, который отлично работал на мышах и крысах, а у женщин вызывал тяжелые пороки развития плода.
Оптимисты – в поисках бессмертия
На сегодня всем ясно, что универсального средства от старости в ближайшее время придумать не получится. И все же есть те, кто уверен, что жизнь человека можно научиться значительно продлевать уже сейчас.
Один из таких энтузиастов, британский биогеронтолог О. Ди Грей, основал фонд, названный в честь Мафусаила, дедушки Ноя, который, как написано в Библии, прожил 969 лет. Фонд Мафусаила поддерживает исследования, направленные на создание антивозрастных технологий. Другой фонд, основанный ученым, – Longevity Escape Velocity – пропагандирует идею «отрыва от старости», когда разработка технологий увеличения продолжительности жизни должна занимать меньше времени, чем число «добавленных» лет.
Поэтому Ди Грей и его союзники считают, что ждать милостей от природы, как и новых фундаментальных открытий от ученых, не нужно, а нужно смело применять все вообразимые и уже существующие технологии. Они верят, что в результате комбинированного действия удастся добиться воздействия на организм, обеспечивающего комплексную репарацию органов и омоложение.
Правда, несмотря на рассуждения о бессмертии, миссия Фонда Мафусаила пока скромнее: к 2030 г. «сделать 90 новыми 50». Эта позиция приветствуется многими, ведь никто не хочет прожить дополнительные годы развалиной, потерявшей способность соображать и свободно передвигаться. А вот чувствовать себя в 90 лет так, как 50‑летний, – это реальная задача.
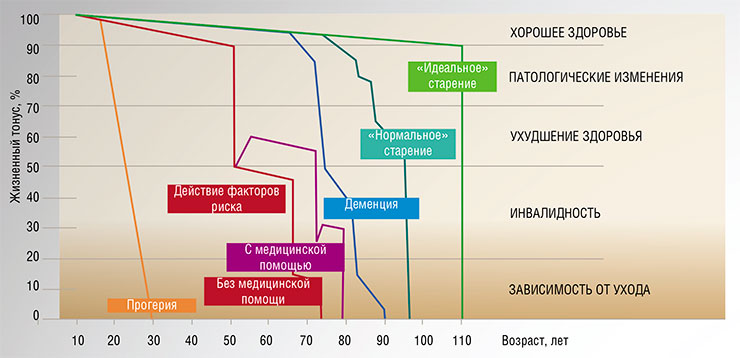
У современного человека можно выделить несколько типичных процессов старения в зависимости от состояния здоровья. Ускоренное старение вызывают такие факторы риска развития болезней, как высокое кровяное давление, курение, алкоголь и др. Все они могут становиться причинами возникновения неотложных состояний, например инсульта или инфаркта. Однако и в этом случае благодаря своевременной терапии можно добиться улучшения показателей жизнеспособности и увеличения продолжительности жизни. Для деменции характерно резкое снижение жизненных показателей с длительным периодом нетрудоспособности. Public Domain Dedication/Armin KübelbeckИсследования здоровья супердолгожителей показали, что около 10 % этих людей доживают до своих последних трех месяцев жизни, так и не заболев основными старческими недугами (сердечно-сосудистыми болезнями, болезнью Паркинсона, слабоумием и т. п.), и умирают тогда, когда их внутренние органы оказываются неспособны поддерживать постоянство внутренней среды организма (гомеостаз)
В начале 2023 г. фонд LEV начал масштабную программу исследований возможности омоложения мышей с помощью комбинаций разных препаратов, которые, как предполагают, могут тормозить процессы старения и работать синергично. На лабораторных мышах будут опробованы рапамицин, сенолитик навитоклакс, генная конструкция по доставке теломеразы и гемопоэтические стволовые клетки, которые при трансплантации в костный мозг производят клетки крови и иммунные клетки, а также все эти средства в различных комбинациях.
Но помимо проблемы продления максимальной продолжительности жизни есть и другая трудность, этическая: насколько целесообразно такое продление?
Уже в «Путешествиях Гулливера» Д. Свифта мы найдем описание струльдбругов – бессмертных островитян, влачащих в старости существование, полное болезней и страданий. Не правда ли, безрадостное будущее?
Медицина уже снизила смертность в ранние годы жизни, что увеличило число людей, доживающих до практически беспомощного состояния. Так что современных долгожителей можно поделить на две категории: одни долго живут и не болеют, другие болеют, но живут благодаря современной медицине, позволяющей эти болезни контролировать.
Сейчас медики могут долгое время сохранять жизнь тяжело болеющим и страдающим людям, но гуманно ли это? Каждый решает для себя. Например, американский онколог и биоэтик И. Эмануэль, один из научных консультантов американского президента Д. Байдена, защищает идею «своевременной смерти». Он решил отказаться от медицинской помощи (антибиотиков, вакцин) по достижении 75 лет, чтобы избежать серого конца жизни. Правда, пока ему не исполнилось и 70 – есть время изменить свое мнение.

Современная медицина уже способна значительно продлить время здоровой жизни среднего человека. А столетние, может, жили бы еще дольше и без всяких волшебных технологий, если бы получали больше внимания врачей. Но этих людей не лечат должным образом. Протезирование суставов, пересадка органов, активная терапия рака – все это считается слишком дорогим для того, чтобы продлить на несколько лет жизнь уже и так очень старого человека.
Но если продлить время здоровой жизни, это автоматически удлинит и ее общую продолжительность. И задача медицины – сохранять здоровье людей, лечить, не думая о ее продлении. А верхним пределом жизни и бессмертием пусть занимаются теоретики и фантасты.
Судя по всему, нас не ждет одно выдающееся открытие, которое радикально решит проблему старения. Будет много разных открытий, которые подготовят фундамент для создания новых технологий и препаратов, позволяющих бороться с заболеваниями старческого возраста, замедляющих развитие в организме патологических процессов и устраняющих повреждения биомолекул и клеток. Именно они и обеспечат рост продолжительности жизни.
Однако это прогноз на основе сегодняшних знаний. Молекулярная биология – наука молодая, и могут произойти удивительные открытия, которые изменят нынешнюю точку зрения. Еще каких-то тридцать лет назад студентов в университетах учили, что клонирование млекопитающих невозможно, и даже объясняли почему. А потом родилась овечка Долли… Почему бы не появиться принципиально новым технологиям, которые действительно позволят повернуть вспять процессы старения?
Читатель может спросить: все вышесказанное относится к исследованиям, которыми, как известно, ученые могут заниматься бесконечно. А как жить сейчас? Ведь годы идут. Можно ли что-то предпринять? Наш ответ таков: да, со старением можно и нужно бороться, и многого можно достичь уже сейчас, используя имеющиеся знания. Но об этом – в следующей статье.
Литература
Анисимов В. Н. Эликсир молодости из крови? //
НАУКА из первых рук. 2015. № 1 (61). С. 16–19.
Блэкберн Э. Э., Эпель Э. Эффект теломер. Революционный подход к более молодой, здоровой и долгой жизни. М.: Бомбора, 2020. 544 с.
Графодатский А. С., Трифонов В. А. Родиться баобабом // НАУКА из первых рук. 2020. № 5/6 (85). С. 16–31.
Королева А. Г. Структура и длина теломер: загадкам нет конца // НАУКА из первых рук. 2016. № 3(69). С. 72–83.
Лосева П. Против часовой стрелки: Что такое старение и как с ним бороться. М.: Альпина нон-фикшн, 2022. 468 с.
Сидоренко А. В. Большое старение // НАУКА из первых рук. 2008. № 1 (19). С. 70–83.
Федичев П. О. Взломать старение: Почему теперь мы сможем жить дольше. М.: Альпина Паблишер, 2023. 356 с.
Обширную информацию о проблемах старения и борьбе с ним можно найти на сайте nestarenie.ru, а также на сайте благотворительного фонда поддержки научных исследований «Наука за продление жизни (Open Longevity)» (scienceagainstaging.com). Что касается печатных изданий, с ними нужно быть осторожными: на книжных полках много изданий на эту тему, авторы которых – откровенные шарлатаны. Можно рекомендовать работы известного российского геронтолога, член-корреспондента РАН А. А. Москалева и академика РАН В. П. Скулачева
ИСТОЧНИК: Наука из первых рук https://scfh.ru/papers/dolgoletie-ot-fantaziy-k-tekhnologiyam-prodleniya-zdorovoy-zhizni/

