Редактирование генома в терапии наследственных заболеваний
Наследственность – это своего рода фатализм нашего времени. Расшифровка последовательности ДНК сродни предсказанию судьбы человека. Нам говорят, что гены определяют все: от цвета глаз до склонности к девиантному поведению. Добавьте к этому болезни, передающиеся по наследству, и мутации, связанные с риском развития таких болезней, как рак.

Немудрый Артем Александрович младший научный сотрудник
Институт цитологии и генетики СО РАН
Институт химической биологии и фундаментальной медицины СО РАН

Закиян Сурен Минасович zakian@bionet.nsc.ru
д.б.н.
профессор
зав. лабораторией
Институт химической биологии и фундаментальной медицины СО РАН
Институт цитологии и генетики СО РАН
Сибирский федеральный биомедицинский исследовательский центр им. академика Е. Н. Мешалкина
Но можно ли пойти наперекор зловещему року и изменить судьбу, записанную на «скрижалях» ДНК? Да, это возможно, и если не сегодня, то в недалеком будущем. Генетическая инженерия занимается этими проблемами уже несколько десятков лет, однако в последние годы вокруг редактирования геномов возник особый ажиотаж. Что же изменилось? Ответ на этот вопрос – аббревиатура CRISPR/Cas
Все началось в 1987 г., когда в бактериальной ДНК были обнаружены странные нуклеотидные повторы, разделенные небольшими участками уникальных последовательностей. Спустя десять лет было показано, что эти повторенные последовательности, названные CRISPR (Clustered Regularly Interspaced Short Palindromic Repeats), являются системой адаптивного иммунитета бактерий – способом защиты против чужеродной ДНК, в частности, против бактериальных вирусов (бактериофагов).
Но какое отношение имеет это к наследственным болезням человека? Все дело в механизме действия системы CRISPR. Бактериофаги впрыскивают в клетку бактерии свою ДНК, которая многократно копируется и упаковывается в белковую оболочку за счет «хозяина» – таким образом на свет появляются новые бактериофаги. Защитная система бактерии, включающая белок-«ножницы» Cas, распознает чужую ДНК в случае, если она уже встречалась с ней раньше, и разрезает ее. Захватчики побеждены.
Узнавание мишени происходит по знаменитому принципу комплементарности, по которому образуются пары нуклеотидов в двуспиральной структуре ДНК. Этот принцип работает во всех живых организмах на нашей планете, включая клетки человека. Поэтому главное в механизме CRISPR/Cas – его простота и универсальность.
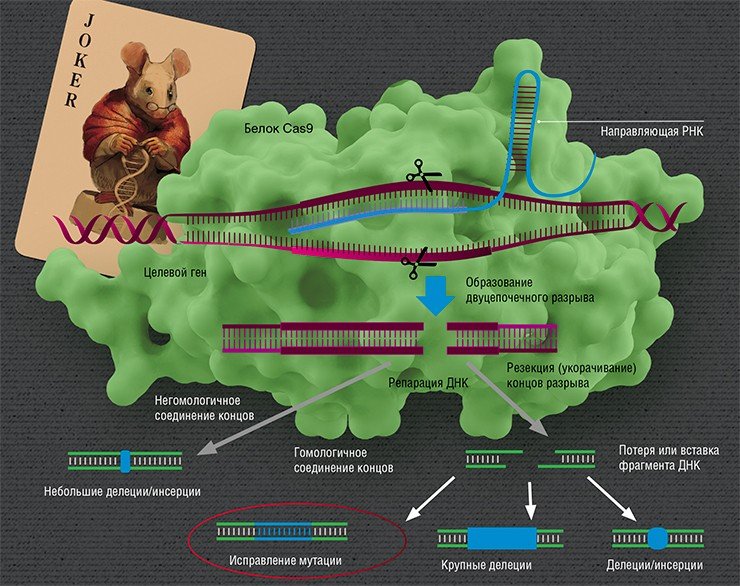
Эффектором системы геномного редактирования CRISPR/Cas является комплекс РНК с белком Cas9 бактерии Streptococcus pyogenes. В этом комплексе направляющая РНК отвечает за распознавание гена-мишени, а белок вносит разрыв. Репарация ДНК в месте разрыва может происходить разными путями. При «прямом» сшивании путем негомологичного соединения концов в ДНК с большой частотой могут возникнуть мутации. Также можно исправить первоначальную мутацию путем гомологичной рекомбинации с сестринской хромосомой либо искусственной донорской молекулой ДНК. При этом возможно образование случайных мутаций, связанных с потерей или вставкой нуклеотидов. По: (Ceccaldi et al., 2016)
Знаковое событие случилось в 2012 г., когда была опубликована совместная работа француженки Э. Шарпентье и американки Д. Дудна, где было показано, что бактериальная система CRISPR/Cas может быть использована для внесения разрывов в последовательность любой ДНК, что свидетельствовало об ее огромном потенциале для редактирования геномов (Jinek et al., 2012). Ведь, зная нуклеотидную последовательность, можно внести разрыв в точно выбранное место любой ДНК.
Так в руках ученых оказался простой и эффективный инструмент, позволяющий направленно вносить изменения в ДНК живой клетки, т. е. переписывать те самые «скрижали». С тех пор вышли сотни научных статей, свидетельствующих о том, что эта система работает в самых различных видах организмов, позволяет вносить разрывы в любые последовательности генов, в том числе несущие мутации, вызывающие наследственные болезни (Немудрый, 2014).
Ремонтируем ДНК направленно
Но вот ДНК разрезана – что дальше? Дальше идет «ремонт» (репарация). Вообще разрывы в ДНК не такая уж и редкость: ежесуточно в каждой клетке человека под действием активных форм кислорода их возникает около 10 тысяч, и клетка их тщательно «штопает», восстанавливая целостность ДНК (Helbock et al., 1998). Но эти разрывы случайны, в отличие от действия CRISPR/Cas.Существуют «терапевтические» мутации, предотвращающие развитие заболеваний. Например, мутации в гене CCR 5 предотвращают заражение клеток ВИЧ (Genovese et al., 2014, Liu et al., 1996), а мутация A673T в гене APP – развитие болезни Альцгеймера (Jonsson et al., 2012). С помощью системы CRISPR/Cas можно внести в геном необходимые изменения, «сломав» целевые гены либо внеся целевые замены (Cox et al., 2015)
Направленные разрывы, внесенные CRISPR/Cas, могут быть репарированы по-разному: существует несколько способов, отличающихся механизмом, точностью и т. п. В зависимости от пути репарации можно получить следующие результаты. Во-первых, «сломать» ген, если при репарации ДНК произойдет мутация. Такого эффекта можно добиться, если репарация произойдет, например, по механизму соединения негомологичных концов, для которого характерна неточность. Также возможно добиться крупной делеции (утраты фрагмента ДНК) и удалить участок либо целый ген.
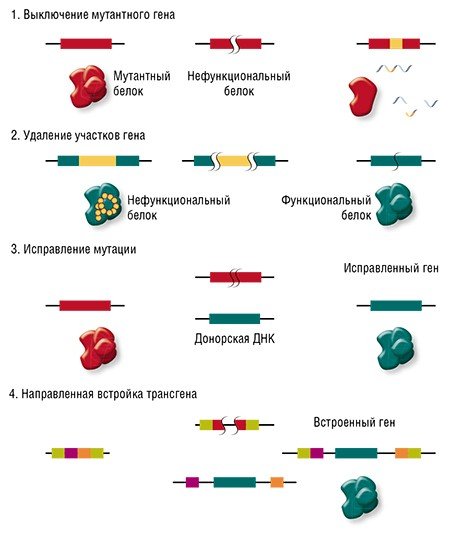
Во-вторых, можно «переписать» определенную последовательность ДНК в клетке. Как известно, при репарации разрывов по пути гомологичной рекомбинации восстановление поврежденного участка ДНК идет по шаблону сестринской хромосомы (в клетках у нас присутствует по две копии каждой хромосомы – от отца и от матери). Фокус в том, что клетку можно обмануть, «подсунув» ей вместо сестринской хромосомы искусственно созданную «донорную» ДНК. Если такая ДНК будет «похожа» на поврежденный участок, то клетка может использовать ее в качестве образца.
Сестринская хромосома присутствует в клетке в единичном экземпляре, а копий «донорной» ДНК можно доставить множество, что дает искусственной ДНК конкурентное преимущество, пусть она и отличается немного от поврежденного участка. Таким образом можно «исправить», к примеру, мутацию, или вставить небольшой новый фрагмент ДНК.
И вот здесь мы вплотную подходим к терапии генетических заболеваний. Начнем с того, что все такие патологии отличаются друг от друга: они вызваны мутациями в разных генах, да и сами мутации могут иметь различную природу и давать разный эффект в одном и том же гене. Соответственно, есть разные варианты применения геномного редактирования: ген можно «сломать» или просто удалить мутантный участок, «исправить» мутацию или, напротив, добавить в геном полезные «терапевтические» мутации или даже новый дополнительный трансген.
В теории все это выглядит прекрасно, но вот в чем вопрос: в организме взрослого человека имеются десятки триллионов клеток, и в каждой из них содержится мутантный ген. Как эти подходы применить на практике? Как лечить реального пациента?
Работаем «в пробирке» и в организме
На самом деле в большинстве случаев нет нужды исправлять мутацию в каждой клетке организма. Например, серповидноклеточная анемия вызвана мутациями в гене, кодирующем субъединицу гемоглобина, что приводит к дисфункции только клеток крови – эритроцитов. А наследственные нейродегенеративные заболевания, например боковой амиотрофический склероз, связаны с гибелью нейронов определенных типов. Таким образом, мишенями для терапии многих генетических заболеваний могут быть клетки лишь определенных органов или тканей, где специфично синтезируются/не синтезируются продукты мутантных генов.
Суть редактирования геномов ex vivo («вне живого») заключается во введении в организм «здоровых» клеток, в которых, к примеру, будет синтезироваться нужный белок. Но если вводить клетки, взятые даже от здорового донора, то организм пациента с большой вероятностью их отторгнет. Поэтому нужно взять клетки самого пациента и изменить в них мутантный ген, а потом ввести их обратно. Наиболее разработан этот подход для заболеваний крови, поскольку забор и пересадка костного мозга, где идет кроветворение, практикуется с 1959 г.
Но что делать в случае, если «дефектные» клетки не так просто получить? Например, если болезнь проявляется в головном мозге? Вдобавок не все типы клеток способны пережить все процедуры в чашке Петри вне организма. Здесь на помощь приходит другая крайне перспективная технология нашего времени, связанная с получением так называемых индуцированных плюрипотентных стволовых клеток (ИПСК).Плюрипотентные стволовые клетки бессмертны: теоретически они могут делиться бесконечно и при действии определенных стимулов образовывать любые клетки тканей и органов взрослого организма. Используя необходимый набор стимулов, можно направить развитие стволовых клеток в определенный тип клеток, например, в нейроны. Этот процесс называют направленной дифференцировкой
Относительно простой и эффективный способ получения стволовых клеток из клеток кожи в результате репрограммирования был изобретен в 2006 г. японскими исследователями К. Такахаси и С. Яманака (Takahashi & Yamanaka, 2006). Таким образом, появился метод вернуть практически любую клетку организма (крови, кожи, жировой ткани и т. д.) в состояние стволовой.
Возможность использования ИПСК для клеточной терапии наследственных заболеваний была впервые продемонстрирована на модели серповидноклеточной анемии (Hanna et al., 2007). В геном лабораторных мышей были встроены мутантные гены человека, приводящие к развитию этой болезни.
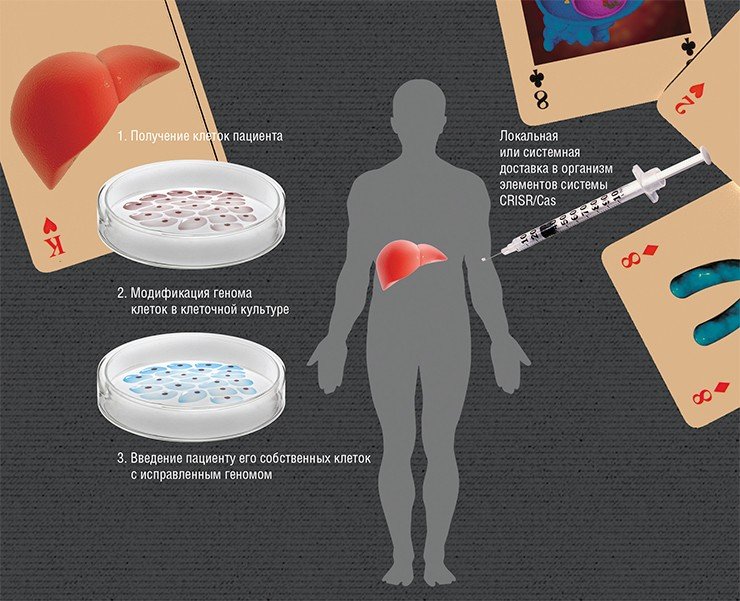
Существует две стратегии редактирования генома у конкретного пациента. В первом случае мутацию, по сути, исправляют в чашке Петри – в культуре собственных клеток человека. Суперсовременная технология выглядит так: у пациента получают, к примеру, клетки крови и «возвращают» их в состояние стволовых. В таких индуцированных плюрипотентных стволовых клетках исправляют мутацию с помощью CRISPR/Cas, а затем путем направленной дифференцировки получают клетки нужной ткани или органа (например, гепатоциты – клетки печени), которые вводят пациенту. Другая принципиальная возможность – редактировать геном клеток непосредственно в организме пациента, вводя ему элементы CRISPR/Cas в кровь либо в конкретный орган. По: (Cox et al., 2015)
Из клеток кожи этих животных были получены индуцированные плюрипотентные стволовые клетки, в которых мутация была исправлена с помощью гомологичной рекомбинации. Путем направленной дифференцировки из этих клеток были получены стволовые предшественницы клеток крови, которые трансплантировали в организм животных. Последние не только прижились, но и превратились в здоровые эритроциты. Лечение оказалось успешным.
С тех пор cписок наследственных болезней, для которых успешно был опробован этот подход, пополнился десятками наименований и продолжает расти.
Но зачем тратить время и деньги на извлечение и культивирование клеток, если можно все сделать прямо «на месте»? Ведь система CRISR/Cas в силу своей универсальности теоретически способна работать непосредственно в клетках живого организма. Главная проблема – это эффективно и безопасно доставить элементы этой системы в нужное место.
Сегодня наиболее часто для доставки генов CRISPR/Cas в организм используются вирусные частицы. В качестве таких носителей обычно выступают аденоассоциированные вирусы – дефектные вирусы, способные размножаться только в присутствии «помощников»-аденовирусов. Эти вирусы эффективно заражают клетки человека, но не вызывают у него никаких патологий. А вирусные частицы, в геном которых встроены гены CRISPR/Сas, после заражения уже не могут размножаться. При этом разные серотипы этих вирусов имеют «склонность» к разным тканям. Например, серотип AAV8 предпочитает ткани печени, а уже сегодня можно создать искусственные серотипы, нацеленные на любой орган.
Активно развиваются и невирусные способы доставки, например, упаковка готовых молекулярных комплексов РНК-белок в липосомы (липидные пузырьки) или полимерные частицы. Это более безопасно, а также обеспечивает более строгий контроль над дозой.
Это все здорово, но…
Всегда есть это «но». Технология CRISPR/Cas начала применяться для редактирования геномов млекопитающих пять лет назад. На сегодня получено колоссальное количество данных, достигнут огромный прогресс на пути к клиническому применению, но все же остается ряд вопросов, которые необходимо будет решить для каждого конкретного генетического заболевания. Например, какая доставка будет оптимальна? Приживутся ли введенные клетки? Какова будет эффективность и безопасность лечения? И etc. …
Возьмем для примера пару вопросов из этого списка и посмотрим, какие конкретные ответы на них уже получены в научном сообществе. Одна из проблем использования CRISPR/Cas связана с возможностью нецелевых эффектов: система может вносить разрывы в участки, отличающиеся от целевого на несколько «букв» – нуклеотидов, что чревато риском возникновения нежданных мутаций. Особенно остро вопрос безопасности стоит при редактировании геномов in vivo, когда проверить результат предварительно невозможно.
Для решения этой проблемы лидирующие группы ученых под руководством Д. Дудны, Ф. Чжана и К. Джуна независимо друг от друга создали мутантные «улучшенные» варианты белка Cas9 с повышенной специфичностью, частота нецелевых эффектов которых упала на несколько порядков.С помощью технологии геномного редактирования можно не только лечить наследственные заболевания, но и создавать «дизайнерских» детей. Ведь если можно исправить ген, вызывающий болезнь, то почему бы не изменить ген, регулирующий цвет глаз, продолжительность жизни, наконец, интеллект? Уже сегодня в Китае с помощью CRISPR/Cas выведены собаки породы бигль, у которых «выключен» ген, кодирующий миостатин – фактор, подавляющий рост мышечной ткани. В результате эти животные отличаются повышенной мускулистостью. А что мешает «выключить» этот ген в эмбрионе человека?
Что касается эффективности терапии, то все зависит от особенностей самого заболевания и мутации, его вызывающей. Возможны три варианта: после исправления мутации жизнеспособность клеток увеличится, не изменится или ухудшится. В первом случае исправленные клетки получают конкурентное преимущество и могут постепенно заместить мутантные. Например, на линии мышей с наследственным заболеванием печени – тирозинемией I типа – было показано, что при системной доставке CRISPR/Cas непосредственно в организм животного мутация «исправляется» в 6 % клеток печени. Даже такого небольшого количества клеток достаточно, чтобы предотвратить падение веса и привести в норму биохимические показатели печени животных. А более жизнеспособные клетки с исправленной мутацией начинают «обживать» печень.
Но, к примеру, в случае гемофилии B жизнеспособность клеток после исправления мутации не повышается. Тем не менее уже 3—7 % клеток печени, продуцирующих нормальный фактор свертывания крови, достаточно для устойчивого терапевтического эффекта (Ohmori et al., 2017).
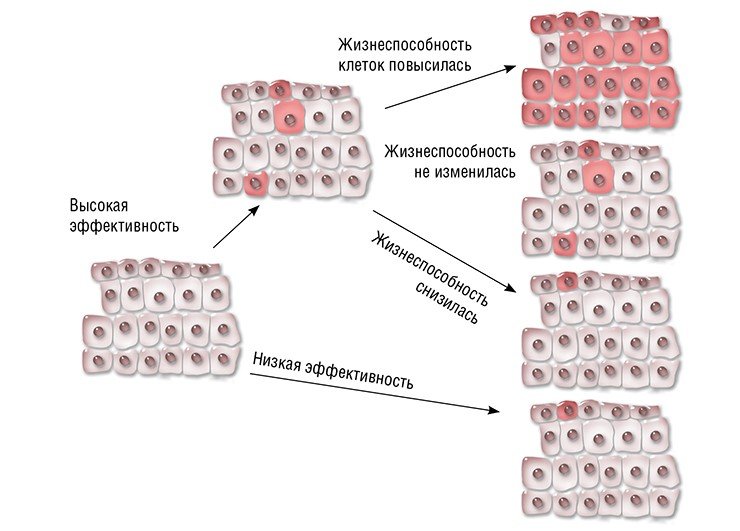
Эффективность терапии с помощью редактирования генома зависит от того, насколько жизнеспособными будут измененные клетки. Если исправление мутации повышает жизнеспособность клеток, они могут замещать другие клетки мутантного генотипа. По: (Cox et al., 2015)
Что же касается исправления мутаций в онкогенах, то жизнеспособность и скорость пролиферации таких клеток будет снижаться относительно раковых, поэтому эффективность подобной терапии вызывает сомнения.
Тем не менее пример гемофилии B показывает, что если заболевание связано с отсутствием какого-то фермента или гормона, то небольшого числа клеток, его продуцирующих, может хватить, по крайней мере, для перевода болезни в более мягкую форму, а в некоторых случаях и для полного восстановления утраченных функций.
Классическими же модельными заболеваниями в исследованиях по терапии с помощью геномного редактирования являются гемоглобинопатии и мышечная дистрофия Дюшенна. Именно на этих заболеваниях была подтверждена работоспособность концепций такого лечения, показано, что клетки с исправленной мутацией демонстрируют «здоровый» фенотип. В случае мышечной дистрофии Дюшенна такие клетки не только успешно встраивались в мышечную ткань взрослых мышей, но и улучшали функциональные показатели всей мышцы в целом.
Система CRISPR/Cas9 открывает перед человечеством большие перспективы, но нужно понимать, что это не волшебная палочка для решения всех проблем, а инструмент, такой, как, например, молоток. И нужно учиться применять этот инструмент для каждой конкретной задачи.
Главный шаг, который уже был сделан в этой области, – это выход за пределы лабораторий. Уже существует ряд компаний, занимающихся внедрением технологии CRISPR/Cas в практику, и не только медицинскую. Этот подход, к примеру, используется сегодня для получения модифицированных микробов для нужд биотехнологии и модифицированных растений.
Можно ожидать, что уже в ближайшее десятилетие новая технология найдет и клиническое применение. Так, в 2016 г. в Китае стартовали первые клинические испытания нового метода иммунотерапии метастазирующего немелкоклеточного рака легкого, в котором используются T-лимфоциты с «отредактированным» геномом.
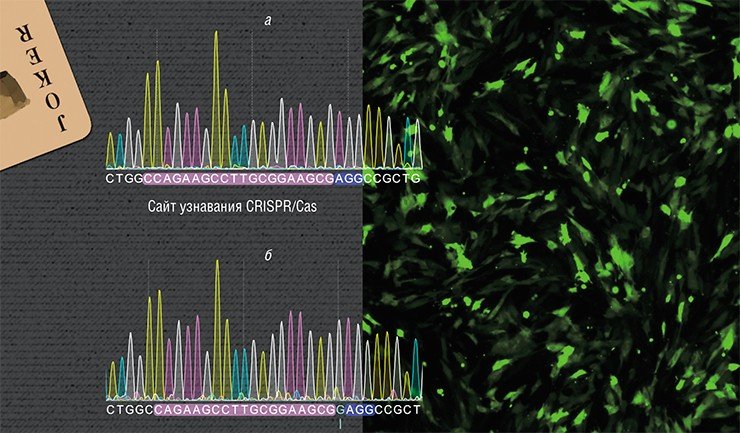
У лабораторных крыс линии Brattleboro имеется рецессивная точечная мутация в участке гена AVP, кодирующего гормон вазопрессин – выпадение (делеция) гуанина. В экспериментах по геномному редактированию в ИЦиГ СО РАН из фибробластов кожи этих животных были получены индуцированные плюрипотентные стволовые клетки. В конечном счете удалось получить линии стволовых клеток с исправленной мутацией, которые можно использовать в терапевтических целях. Вверху – секвенограммы нуклеотидной последовательности фрагмента гена AVP мутантных клеток (а) и клеток с исправленной мутацией (б)С. М. ЗАКИЯН: «НАМ БЫЛ БРОШЕН ВЫЗОВ, И МЫ ДОЛЖНЫ НА НЕГО ОТВЕТИТЬ!»Исследования по применению системы CRISPR/Cas для терапии наследственных заболеваний начались в лаборатории эпигенетики развития ИЦиГ СО РАН под руководством С. М. Закияна в 2013 г., буквально сразу после выхода первых публикаций на эту тему.
Исследования ведутся на лабораторных крысах линии Brattleboro – модели генетически детерминированного заболевания, при котором наблюдается дефицит гормона аргинин-вазопрессина. В результате у животных развивается наследственный несахарный диабет с характерным для него чрезмерным потреблением жидкости. На сегодня уже получена линия клеток с исправленной мутацией в гене, кодирующем этот гормон.
В данном случае задача усложнялась тем, что ген вазопрессина по последовательности нуклеотидов схож с геном другого гормона – окситоцина. Более того, на участке, в котором возникла мутация у крыс Brattleboro, эти гены практически идентичны. Тем не менее удалось добиться специфичного действия CRISPR/Cas в гене вазопрессина без нецелевых двунитевых разрывов ДНК в гене окситоцина. На следующем этапе предполагается вводить исправленные клетки в организм животных для оценки терапевтического эффекта
Возможности, которые дает нам технология CRISPR/Cas, пугающие и захватывающие одновременно. Сначала китайские исследователи, а затем их коллеги из США смогли внести изменения в эмбрионы человека. Недавно группа американских ученых под руководством Ш. Миталипова «исправила» в человеческом эмбрионе мутацию, вызывающую гипертрофическую кардиомиопатию (Ma et al., 2017). Эти эмбрионы были получены специально в результате искусственного оплодотворения, для которого были использованы здоровая яйцеклетка и сперматозоиды носителя мутации. Согласно современным нормам, зародыши были выведены из эксперимента на стадии бластоцисты. Однако с помощью современных репродуктивных технологий уже сегодня можно было бы имплантировать такие эмбрионы суррогатным матерям.
И здесь возникает очень серьезный этический вопрос: имеем ли мы право вмешиваться в ДНК человека? Или, наоборот, этично ли бездействовать, обрекая будущего ребенка на страдания?
Генетические изменения, внесенные в эмбрионы, сохранятся во всех клетках взрослого организма, и, соответственно, будут передаваться по наследству. Какой эффект окажет распространение таких модифицированных генов на человеческую популяцию в эволюционном аспекте, не говоря уже о риске возникновения новых евгенических движений?
Именно поэтому Д. Дудна, имеющая колоссальный авторитет в научном мире, призывает своих коллег не торопиться с применением этой технологии на эмбрионах человека, пока не будут разработаны международные этические и законодательные нормы для ее регулирования. В наши дни по всему миру проходят встречи, конференции, конгрессы и симпозиумы, на которых обсуждается будущее CRISPR/Cas. Возможно, от решений, которые будут приняты на них сейчас, зависят судьба человечества и то, как будет выглядеть наш мир в будущем.
Литература
Немудрый А. А., Валетдинова К. Р., Медведев С. П. и др. Системы редактирования геномов TALEN и CRISPR/Cas – инструменты открытий // Acta Naturae. 2014. Т. 6. № 3(22). С. 20—42.
Cox D. B., Platt R. J., Zhang F. Therapeutic genome editing: prospects and challenges // Nat Med. 2015. V. 21. N. 2. P. 121—131.
Jinek M., Chylinski K., Fonfara I. et al. A Programmable Dual-RNA-Guided DNA Endonuclease in Adaptive Bacterial Immunity // Science. 2012. V. 337. N. 6096. P. 816—821.
Ma H., Marti-Gutierrez N., Park S. W. et al. Correction of a pathogenic gene mutation in human embryos // Nature. 2017. V. 548. N. 7668. P. 413—419.
ИСТОЧНИК: Наука из первых рук https://scfh.ru/papers/redaktirovanie-genoma-v-terapii-nasledstvennykh-zabolevaniy/

